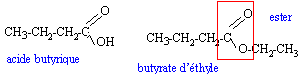|
|
||||||
|
||||||
|
|
Les parties I, II et III sont indépendantes Un berlingot de 250 mL d'eau de Javel titre 48 ° chl. Donnée : volume molaire dans les conditions normales de température et de pression : Vm = 22,4 L/mol. I. préparation de l'eau de javel : En milieu basique le dichlore peut subir une réaction chimique pour former de l'eau de Javel suivant l'équation : Cl2 + 2OH- --> ClO- + Cl- + H2O a) Quel nom particulier donne-t-on à cette réaction chimique ? b) Définir le degré chlorométrique (° chl) d'une eau de Javel ? c) Montrer que le volume de dichlore nécessaire pour préparer ce berlingot de 250 mL d'eau de javel est V = 12 L. d) Vérifier que la quantité de matière " n " (en mol) de dichlore correspondant à ce volume V = 12 L est n = 0,54 mol. e) Sachant qu'une mole de dichlore Cl2 donne une mole d'ions hypochlorite ClO-, en déduire la quantité d'ions hypochlorite, exprimée en mole, présents dans ce berlingot. II. dosage des ions hypochlorites : On veut vérifier que la quantité d'ions hypochlorite présents dans ce berlingot corresponde bien au titre annoncé. Pour cela, on prélève un volume v = 25 mL de cette eau de Javel que l'on mélange avec un excès d'ions iodure. L'équation bilan de la réaction qui a lieu alors est : 2I- + ClO- + H2O--> I2 + Cl- + 2OH- a) Par dosage, on détermine qu'il s'est formé 5,4.10-2 mol de diiode I2 au cours de la réaction. D'après l'équation bilan, déterminer la quantité d'ions hypochlorite ClO- contenu dans les 25 mL d'eau de Javel ? b) En déduire le nombre de moles d'ions hypochlorite contenu dans le berlingot de 250 mL. III. précaution d'emploi de l'eau de Javel : La totalité de ce berlingot a été mélangé par inadvertance avec un détartrant contenant de l'acide chlorhydrique. L'équation bilan de la réaction est : ClO- + 2H+ + Cl- -->Cl2 + H20 a) Préciser le nom du gaz toxique qui s'est dégagé. b) En admettant que toute la quantité des ions hypochlorite présents dans le berlingot, soit n = 0,54 mol, ont réagi avec l'acide chlorhydrique, quel volume de gaz s'est-il dégagé ?
|
|||||
|
Le degré chlorométrique d'une eau de Javel est le volume de dichlore (en litres) nécessaire à la fabrication d'un litre d'eau de Javel, dans les conditions normales de température et de pression. L'eau de Javel du berlingot titre 48 chl. Il faut donc 48 litres de dichlore pour préparer 1 litre de cette solution. Pour préparer 250 mL = 0,25 L, le volume de dichlore nécessaire est donc 48 /4 = 12 L. Dans les C.N.T.P., le volume molaire des gaz est Vm = 22,4 L mol-1 Qté de matière de dichlore = volume (L) / volume molaire (mol/L) =12/ 22,4 = 0,54 mol. 1 mole de Cl2 donne 1 mole d'ions ClO-, donc n moles de Cl2 donne n moles d'ions ClO- : la quantité d'ions hypochlorite présents dans ce berlingot est donc : n = 0,54 mol. Dosage des ions hypochlorite D'après l'équation - bilan, n (ClO- )qui a réagi = n(I2) formé = 0,054 mol c'est la quantité d'ions hypochlorite contenue dans les 25 mL d'eau de Javel. Donc, dans le berlingot de volume V = 250 mL = 10 × 25 mL, la quantité d'ions ClO- est n' = 10 × n = 0,54 mol. Précaution d'emploi de l'eau de Javel Le gaz toxique dégagé est le dichlore. D'après l'équation-bilan : n (ClO- )qui a réagi = n(Cl2) formé = 0,54 mol Qté de matière (mol) = volume du gaz (L) / volume molaire (L/mol) Donc, dans les conditions normales de température et de pression, le volume de dichlore dégagé est : 22,4*0,54 = 12 L. (le même volume que celui nécessaire pour préparer la solution du berlingot).
|
||||||
|
les savons : les savons ont été fabriqués et utilisés dès la plus haute Antiquité. On retrouve une description de leur fabrication -en faisant réagir des graisses et des huiles animales ou végétales avec les cendres alcalines de certains végétaux- dans le papyrus égyptien d'Ebers qui date de 1550 avant J.C. Les travaux de CHEVREUL -chimiste français (1786 - 1889)- sur les corps gras (acides gras -notamment l'acide stéarique- et triglycérides), ont permis d'améliorer notablement la technologie utilisée dans la savonnerie. I Acides gras et alcool : L'acide butyrique (encore appelé acide butanoïque) réagit avec l'éthanol pour donner de l'eau et du butanoate d'éthyle de formule semi-développée plane:  a) A partir de la formule de butanoate d'éthyle, retrouver les formules de l'acide butyrique et de l'éthanol. b) Recopier la formule semi-développée du butanoate d'éthyle, et identifier sur cette formule le groupe fonctionnel ester. II. Triglycéride et savon : La stéarine est un triglycéride présent dans la graisse de porc et dans le beurre ; elle réagit avec la soude selon l'équation-bilan suivante : 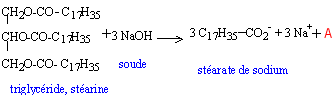 a) Ecrire la formule du composé A et donner son nom. b) Le savon formé est le stéarate de sodium de formule : C17H35COO- + Na+ ; celle-ci peut être représentée par le schéma suivant :  Après avoir rappelé la signification des mots : hydrophile et hydrophobe, recopier le schéma précédent puis identifier nettement les pôles hydrophile et hydrophobe de ce composé. c) Une mole de stéarine donne après saponification, 3 moles de stéarate de sodium. On traite 100 moles de stéarine par de la soude en excès. En déduire la quantité n, exprimé en moles, de savon obtenu puis calculer la masse m correspondante. Donnée : M (stéarate de sodium) = 306 g / mol.
corrigé éthanol CH3-CH2OH
A est le glycérol HOCH2-CHOH-CH2OH ( propan-1, 2, 3-triol) hydrohhile = "qui aime l'eau" - COO- constitue le pôle hydrophile. hydrophobe = "qui déteste l'eau" La chaîne carbonée constitue le pôle hydrophobe. 1 mole de stéarine donne 3 moles de stéarate de sodium (savon), donc 100 moles de stéarine donnent une quantité de savon égale à : n = 300 mol. Or qté de matière (mol) = masse (g) / masse molaire (g/mol) donc la masse de savon obtenue est : m = 300 * 306 = 91,8 kg.
|
||||||
|
le radium et les radionucléïdes: l'élément radium : en décembre 1898, Pierre et Marie CURIE découvraient un nouvel élément, qu'ils appelaient radium. Cet élément est radioactif.
22688Ra -->42He
+ ...+g. les radionucléides : Certains radionucléides sont utilisés en scintigraphie pour effectuer un diagnostic médical. L'un des plus utilisés est le technétium 9943Tc , qu'on injecte dans des organes du corps humain et dont on suit le déplacement et la fixation dans ces organes. Le technétium 9943Tc est un émetteur g et sa période (ou demi-vie) est T = 6 heures.
corrigé Noyau de radium : 22688Ra Z = 88 = nombre de protons du noyau A = 226 = nombre de nucléons Donc A - Z = 138 = nombre de neutrons du noyau Lors de la désintégration radioactive, il y a conservation : du nombre de masse A, donc 226 = 4 + 222 de la charge électrique, donc 88 = 2 + 86 Le nucléide-fils obtenu est donc : 22286Pb 42He est un noyau d'HELIUM 23088Ra est un isotope de 22688Ra: ces deux noyaux contiennent
le même nombre de protons (ce qui définit le même élément Ra) mais des
nombres distincts de nucléons (donc de neutrons).
La période d'un élément radioactif est la durée au bout de laquelle le nombre de noyaux d'un échantillon (donc son activité) a diminué de moitié. On peut considérer que la solution n'est plus radioactive au bout de : 20 T soit 120 heures (ou 5 jours) pour le technétium. Une dose d'irradiation importante peut être cause de stérilité, déclencher des cancers, des leucémies, des mutations génétiques, voire même pour les très fortes doses la mort quasiment immédiate. Les personnels médicaux manipulant les radioéléments, doivent les manipuler à l'aide de bras articulés (prolongeant la main de l'homme). Il doit y avoir un écran entre eux et ces radioéléments : le plomb est particulièrement utilisé.
|
||||||
|