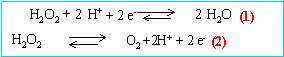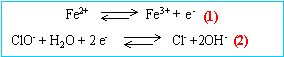|
|
devoirs en
terminale SMS
|
|
|
|
|
1
eau de Javel
|
- Donner le nom de l'ion ClO- qui est le principe
actif de l'eau de Javel.
- Une eau de Javel du commerce a un degré chlorométrique de
48 °chl. Qu'est-ce que cela signifie ?
- On veut préparer un demi-litre d'eau de Javel ayant un
titre 0,48 °chl en utilisant l'eau de Javel du commerce à 48 °chl.
Décrire ou présenter sous forme de schémas les opérations à effectuer
sachant qu'on dispose de pipettes jaugées de 5 mL, 10 mL et 20 mL et
d'une fiole jaugée de 500 mL.
-
On verse de l'eau de Javel dans une solution de
sulfate de fer (II) de couleur vert pâle (Fe2+ ). Le mélange
prend une coloration orangée due à la formation d'ions fer (III) Fe3+.
A l'aide des demi-équations électroniques suivantes :
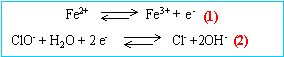
écrire l'équation-bilan de la réaction chimique qui a eu
lieu.
corrigé
|
|
ClO- : ion hypochlorite
Une eau de Javel à 48° chlorométrique :c'est le nombre de
litres de dichlore mesurés à 0°C sous la pression atmosphérique normale
que donne l'acidification complète d'un litre d'eau de Javel selon :
Cl- + ClO- + 2H+ donnent Cl2
+ H2O
D'une part la solution finale est
diluée 100 fois (prélever 10 mL de la solution mère et ajouter 990 mL
d'eau).
D'autre part le volume de la solution fille est de 0,5 L
donc prélever 5 mL à la pipette de la solution mère et
compléter une fiole jaugée de 500 mL avec de l'eau distilée.
Dans une réaction d'oxydo-réduction les
électrons libérés par le réducteur fort réagissent immédiatement avec
l'oxydant le plus fort.
Les électrons n'apparaissent pas dans le bilan. Multiplier la
première par 2 puis ajouter à la seconde.
2 Fe2+ + ClO- + H2O donnent 2
Fe3+ + Cl- + 2 OH-
|
|
2
fabrication
et réaction de l'eau de Javel
|
- L'eau de Javel est obtenue par réaction du dichlore sur une
solution aqueuse d'hydroxyde de sodium (soude). L'équation-bilan de
cette réaction s'écrit :
Cl2 + 2 (Na+ + OH-)
donnent 2 Na+ + Cl- + ClO- + H2O
- Donner le nom des espèces chimiques en solution dans l'eau
de Javel.
- En ne faisant pas figurer les ions Na+, qui ne
réagissent pas, l'équation-bilan s'écrit :
Cl2 + 2 OH- donnent Cl- +
ClO- + H2O
La réaction de fabrication de l'eau de Javel est une
réaction d'oxydo-réduction. Ecrire les deux couples rédox mis en jeu.
- Cette réaction d'oxydo-réduction est une réaction de
dismutation du dichlore. Justifier le terme "dismutation".
- Une dose recharge d'eau de Javel concentrée de volume 250
mL a un degré chlorométrique de 48°chl. En déduire le volume de
dichlore qui a été nécessaire à la préparation de cette dose recharge
dans les conditions normales de température et de pression.
- L'action de l'eau de Javel sur une solution d'iodure de
potassium (K+ + I-) met en évidence l'action de
l'ion responsable des propriétés désinfectantes de l'eau de Javel.
L'équation-bilan de la réaction spontanée s'écrit :
2 I- + ClO- + H2O donnent
Cl- + I2 + 2 OH-
Déduire de l'équation-bilan l'agent actif de l'eau de
Javel. Agit-il par oxydation ou réduction ? Justifier.
corrigé
|
|
|
Cl- : ion chlorure
ClO- : ion hypochlorite
Na+ : ion sodium
Cl2 / Cl-
ClO-
/ Cl2
Le dichlore est l'oxydant de l'un des
couples et le réducteur de l'autre couple. Il joue un double rôle. On
dit "il se dismute"
Un litre de dose recharge libère 48 L de
dichlore.
0,25 litre libère 12 L de dichlore
L'agent actif de l'eau de javel est l'ion
hypochlorite ClO-.
Il joue le rôle d'oxydant .
Il se réduit
La réaction est une réduction
|
|
3
l'eau
oxygénée
|
 oxydo-réduction : fiches interactives oxydo-réduction : fiches interactives
- L'eau oxygénée, antiseptique d'usage courant, est une
solution aqueuse de peroxyde d'hydrogène qui se décompose très
lentement à la température ordinaire. Les demi-équations électroniques
intervenant dans cette décomposition sont
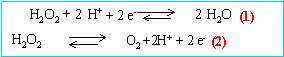
A partir des deux demi-équations précédentes, écrire
l'équation-bilan de la réaction de décomposition de l'eau oxygénée.
- Justifier le nom de "dismutation" donné à cette réaction de
décomposition de l'eau oxygénée.
- Rappeler la définition du titre ou "concentration en
volumes" d'une eau oxygénée.
- Un flacon est rempli à l'aide d'eau oxygénée fraîchement
préparée de concentration molaire égale à 0,89 mol.L-1.
Calculer la "concentration en volumes" de cette eau oxygénée dans les
conditions normales de température et de pression dans lesquelles le
volume molaire Vm = 22,4 L.mol-1.
corrigé
|
|
|
Dans une réaction d'oxydo-réduction les électrons libérés
par le réducteur fort réagissent immédiatement avec l'oxydant le plus
fort.
Les électrons n'apparaissent pas dans le bilan. Ajouter la
première à la seconde.
2H2O2 donnent O2 + 2 H2O
L'eau oxygénée est l'oxydant de l'un des
couples et le réducteur de l'autre couple. Elle joue un double rôle. On
dit "elle se dismute"
Le titre d'une eau oxygénée exprime le volume de
dioxygène (mesuré en L dans les conditions normales de température et
de pression) que peut libérer un litre d'eau oxygénée.
D'après les coefficients de l'équation bilan , à
partir de 0,89 mol d'eau oxygénée on obtient 0,89 / 2 = 0,445 mol de
dioxygène.
Soit en volume : 0,445 * 22,4 = 9,97 L
|
|
4
dosage
d'une eau oxygénée
|
On désire doser une solution de peroxyde d'hydrogène par
manganimétrie. On dispose du matériel et des solutions suivants : un
bécher, une burette graduée, de l'acide sulfurique, V1 = 1
mL d'eau oxygénée incolore de concentration C1 inconnue, une
solution violette de permanganate de potassium (K+ + MnO4-)
de concentration molaire C2 = 0,01 mol.L-1.
- Quel est le but d'un dosage ? Quelle est la solution
titrante ? Quelle est la solution à doser ? Dans ce dosage, l'eau
oxygénée est-elle oxydante ou réductrice ? L'obtention, dans le milieu
réactionnel, d'une coloration rose persistante indique la fin du
dosage. Comment appelle-t-on cette étape ?
- L'équation-bilan de la réaction de dosage s'écrit :

Retrouvez cette équation-bilan à partir des demi-équations
électroniques correspondant aux couples rédox MnO4-
/ Mn2+ et O2 / H2O2.
- Pour avoir l'équivalence, on a dû verser un volume Ve = 9,8
mL de solution de permanganate de potassium. Montrer qu'à l'équivalence
on peut écrire
C1V1 = 2,5 C2Ve
En déduire la concentration molaire C1 de l'eau
oxygénée.
corrigé
|
|
|
Un dosage permet de déterminer la concentration inconnue
de l'un des réactifs à partir d'une réaction d'oxydo réduction (dans le
cas présent) et du changement de couleur d'un indicateur de fin de
réaction (ici l'ion permanganate violet --> ion Mn2+
incolore).
Le permanganate de potassium est la solution titrante.
L'eau oxygénée est la solution à doser.
L'ion permanganate est l'oxydant et l'eau oxygénée le
réducteur.
Lors du changement de couleur , on dit il y a équivalence :
les réactifs mis en présence sont dans les conditions
stoéchiomètriques, proportionnels aux coefficients de l'équation bilan.
L'autre demi équation s'écrit :
H2O2 donne O2 + 2 H+
+ 2 e-
multiplier celle ci par 5, celle concernant l'autre couple par
2 puis ajouter fin que les électrons n'apparaissent pas dans le bilan.
A l'équivalence les quantités de réactifs mis en
présence sont proportionelles aux coefficients de l'équation bilan.
|
permanganate (mol)
|
eau oxygénée (mol)
|
|
coef de l'équation
|
2
|
5
|
|
Qté de matière (mol) à l'équivalence
|
C2Ve
|
C1V1
|
faire les produits en croix.
C = 2,5 *0,01*9,8 / 1 = 0,245 mol L-1.
|
|
|
|
|
|
|