| |
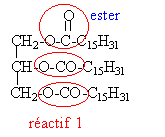
fabrication d'un savon bac 06/00
|
||||||
| |
|
||||||
|
|
saponification |
Données : masses molaires atomiques (g/mol) : C=12 ; H=1 ; O=16. La fabrication du palmitate de sodium se fait par réaction entre la palmitine et une solution basique. Cette réaction a pour équation-bilan : 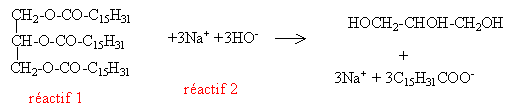
|
|||||
| |
Le réactif 2 est la d'hydroxyde de sodium ou solution de soude. La réaction chimique réalisée est une saponification. La réaction étant totale, la fabrication de 3 moles de palmitate de sodium s'accompagne de la formation d'1 mole de glycérol (d'après les coefficients stoechiométriques de l'équation-bilan). La masse de glycérol C3H8O3 obtenue a donc égale à sa molaire : M= 3*12+8+3*16 = 92 g. Ion carboxylate :
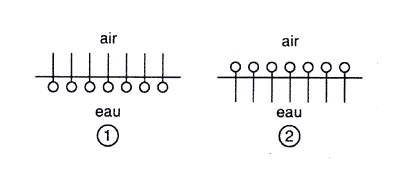
- Partie hydrophile : elle présente une affinité avec l'eau, elle s'y dissout (c'est le groupe carboxylate). - Partie hydrophobe : elle "fuit" l'eau, reste en dehors de l'eau (c'est la chaîne carbonée). Le schéma 1 est exact : Les parties hydrophiles (O) sont dans l'eau. Les parties hydrophobes sont hors de l'eau.
|
||||||
|
|
|