|
classification, structure des molécules, Lewis En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
|
lumière :
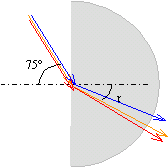
réfraction , dispersion : On fait arriver un mince faisceau de lumière jaune sur la face plane d'un demi-cylindre de Plexiglas sous incidence i = 75°.
compléter un tableau : Un rayon lumineux passe de l'air dans un milieu d'indice de réfraction n. L'angle d'incidence est i et l'angle de réfraction est r.
corrigé |
||||||||||||||||||||||||
|
Une lumière composée de plusieurs radiations colorées est polychromatique le soleil et les lampes à incandescence sont des sources de lumière polychromatiques. La lumière issue d'un laser est constituée d'une seule radiation colorée : elle est monochromatique. La fréquence (hertz) caractérise une lumière monochromatique. L'oeil humain n'est sensible qu'aux radiations dont les longueurs d'onde sont comprises entre 400 et 800 nm. 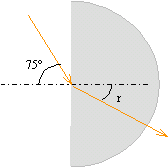
loi de Descartes pour la réfraction : n1 sin i = n2 sin r. avec n1 = 1 et i= 75° ; n=1,485 sin r = sin 75 / 1,485 = 0,966 /1,485 = 0,650 et r = sin-1 0,650 = 40,6 °. lumière bleue : avec n1 = 1 et i= 75° ; n=1,5 sin r = sin 75 / 1,5 = 0,966 /1,5 = 0,644 et r = sin-1 0,644 = 40,1 °. lumière rouge : avec n1 = 1 et i= 75° ; n=1,480 sin r = sin 75 / 1,480 = 0,966 /1,480 = 0,653 et r = sin-1 0,653 = 40,75 °. le plexiglas disperse la lumière polychromatique.
loi de Descartes pour la réfraction : n1 sin i = n sin r sin i = n sin r
|
|||||||||||||||||||||||||
corrigé |
|||||||||||||||||||||||||
|
K2 / Z= 2 donc élément hélium He K2L8M1 : Z=11 donc élément sodium Na. cation sodium Na+ : l'atome de sodium (Z= 11) a perdu un électron Na+ : K2L8 . cation magnésium Mg2+ : l'atome de magnésium (Z= 12) a perdu deux électrons Mg2+: K2L8 . cation aluminium Al3+ : l'atome d'aluminium (Z= 13) a perdu trois électrons Al3+: K2L8 . l'atome de chlore (Z=17 ) gagne un électron et donne l'ion chlorure Cl-. Cl- : K2L8 M8. l'atome de soufre (Z=16 ) gagne deux électrons et donne l'ion oxyde S2-. S2- : K2L8 M8. sixième colonne donc six électrons externes 3ème ligne donc les deux premièers couches électroniques complètes : K2L8M6 : Z= 16 élément soufre les atomes ont tendance à compléter à huit ( à deux pour H) leur dernière couche électronique externe et à acquérir la structure électronique du gaz noble le plus proche H+ : L0. Na+ : K2L8 (structure électronique du néon) S2- :K2L8M8 (structure électronique de l'argon) l'atome d'hydrogène peut former une liaison de covalence et l'atome de soufre deux liaisons de covalence simples.
|
|||||||||||||||||||||||||
| |
|||||||||||||||||||||||||
|