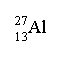| |
origine des exercices ( académie de Lyon) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||
| |
|
||||||
|
|
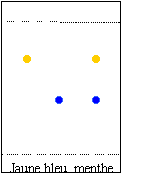
chromatographie des colorants alimentaires |
corrigé |
|||||
| |
décoction ou infusion : laisser un végétal au contact de l'eau chaude afin que certains de ces consituants s'y dissolvent. macération : afin de concerver l'arôme de certains végétaux, on peut les faire macérer , à froid ou à chaud dans des huiles.
Le colorant le plus soluble dans l'éluant utilisé migre le plus vite ; il a le plus grand rapport frontal
|
||||||
|
extraction par solvant |
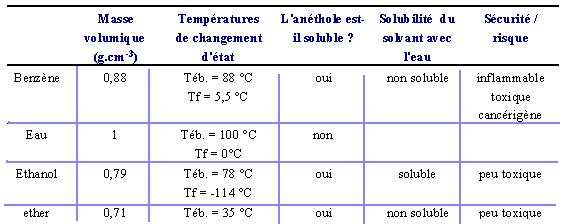
On souhaite extraire l'essence d'anis (appelée anéthole) de grains d'anis. On dispose de plusieurs solvants dont voici les caractéristiques : Données concernant l'anéthole : Téb. = 234 °C Tf = 21,3 °C
corrigé |
||||||
| |
L'anis doit être soluble dans le solvant et le solvant ne doit pas être toxique: donc ether ou éthanol (le meilleur , il n'est pas toxique) Le second solvant ne doit pas être miscible avec l'eau ce qui élimine l'éthanol. Les grains d'anis sont éliminés par filtration L'éthanol est liquide à 0° et à 25° par contre c'est un gaz à 100°. En refoidissant le mélange éthanol + anéthole à une température inférieure à 21°, l'anéthole devient solide : il suffit de filtrer. En distillant ce même mélange l'éthanol s'évapore à 78° et le résidu dans le ballon est l'anéthole.
|
||||||
|
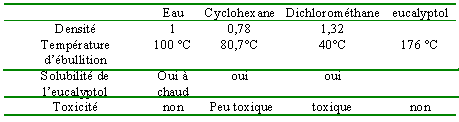
eucalyptol |
corrigé |
||||||
| |
L'eucalyptol est d'autant plus soluble dans l'eau que la température est élevée (tout en restant inférieure à 100°) Le réfrigérant à air condense les vapeurs et évite les pertes de matière.
Après chauffage à reflux, l'eucalyptol étant soluble dans l'eau chaude se trouve dans l'eau. cyclohexane et dichlorométhane sont des solvants aptent à l'extraction (l'eucalyptol y est soluble, beaucoup plus que dans l'eau à 20°). Le dichlorométhane étant toxique , le cyclohexane est préférable. Après décantation l'eucalyptol se trouve dans le cyclohexane, solvant de densité inférieure à celle de l'eau. Le mélange cyclohexane + eucalyptol occupe la partie supérieure de l'ampoule.
|
||||||
|
atomes et ions |
|
||||||
| |
l'atome est globalement neutre (noyau positif au centre et électrons négatifs à la périphérie) protons positifs et neutrons constituent le noyau électrons négatifs dont la masse est environ 2000 fois plus petite que celle d'un nucléon (proton et neutron) un anion est un atome ou un groupe d'atomes ayant gagné un ou plusieurs électrons Cl- chlorure NO3- nitrate SO42- sulfate un cation est un atome ou un groupe d'atomes ayant perdu un ou plusieurs électrons Na+ sodium NH4+ ammonium Ca2+ calcium symboles chimiques: sodium : Na ; zinc Zn ; carbone C Ag : argent Au : or Al : aluminium liaison covalente : mis en commun par 2 atomes d'un ou de plusieurs doublets d'électrons appelés doublets de liaisons ou doublets liants. la dernière colonne de la classification périodique est celle des gaz nobles |
||||||
| |
|
||||||
|
aluminium |
masse du proton, mp = 1,673. 10-27kg ; masse du neutron, mn = 1,675. 10-27kg ; masse de l'électron, me = 9,109. 10-31kg. corrigé |
||||||
| |
ce dernier compte Z=13 protons positifs et A=27 nucléons soit A-Z =14 neutrons masse du noyau : 14* 1,675. 10-27+13*1,673. 10-27 4,52 10-26kg masse des électrons 13 *9,109. 10-31=1,18 10-29 kg environ 2000 fois plus petite que celle du noyau : donc la masse de l'atome est pratiquement égale à celle du noyau de l'atome. 2 électrons sur le niveau n=1 8 électrons sur le niveau n=2 3 électrons sur le niveau externe. Ces 3 électrons sont facilement perdus par l'atome au cours des réactions chimiques et il en résulte l'ion Al 3+ dont la structure électronique est identique à celle du gaz noble le néon.
|
||||||
|
Lewis |
N2 ; C2H2;
CO2 ; ClOH
|
||||||
| |
seuls les électrons externes sont représentés |
||||||
|
isomères |
corrigé |
||||||
| |
|
||||||
|
isotopes |
(3 ; 7) ; (14 ; 28) ; (7 ; 14) ; (20 ; 40) ; (14 ; 29) ; (7 ; 15) ; (14 ; 30) ; (20 ; 41) ; (3 ; 8). Regrouper les isotopes d'un même élément et donner le nom de l'élément.
|
||||||
| |
même nombre de charge Z, mais des nombres de neutrons différents( nombres de masse différents)
|
||||||
|
|
|