|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
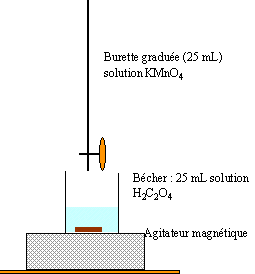
On souhaite titrer par conductimétrie les ions hydroxyde HO-(aq) contenus dans un déboucheur liquide du type Destop. Pour cela, on verse 2,00 mL de déboucheurs, mesurés avec une pipette de précision, dans 500 mL d'eau. On prélève 100 mL de cette solution et on les verse dans un bécher. On ajoute enfin quelques gouttes de bleu de bromothymol (BBT). La solution dans la burette est une
solution d 'acide chlorhydrique, de concentration molaire 0,1 mol.L-1.
Au cours du titrage conductimétrique, on mesure les valeurs de la
tension aux bornes des électrodes et l'intensité du courant qui circule
entre celles-ci. On note également la couleur de la solution dans le
bécher (tableau ci-dessous).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
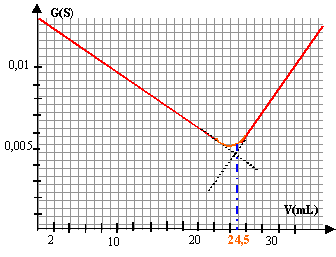
H3O+ + HO- --> 2 H2O la conductance G (S) est calculeé en divisant l'intensité en ampère(1 mA = 10-3A) par la tension en volt .
avant l'équivalence, les ions oxonium ajoutés réagissent avec les ions hydroxyde pour donner des molécules d'eau. La concentration des ions HO- diminue, la conductivité et la conductance de la solution vont donc diminuer. la solution est basique, pH supérieur à 7 ; le BBT, indicateur coloré, est bleu. après l'équivalence, on ajoute des ions oxonium ( dont la conductivité ionique molaire est grande) à la solution : la conductivité et la conductance de la solution vont rapidement augmenter. la solution est acide, pH inférieur à 7 ; le BBT, indicateur coloré, est jaune. L'équivalence est repèrée par l'intersection des deux droites : Véq voisin 24,5 mL d'acide. pH= 7 à l'équivalenceet le BBT est vert.
Qté matière acide (mol) = volume ajouté (L) * 0,1
0,1C = 0,1 Véq = 2,45 10-3 mol d'où C = 2,45 10-2 mol /L or le déboucheur a subit une dilution (
2 mL dans 500 mL d'eau). Le facteur de dilution est de 250 et la
concentration du déboucheur du commerce est : 2,45 10-2 *250 = 6,12 mol/L.
détermination expérimentale : 2,45 10-3 mol indication constructeur : 2,4 10-3 mol écart absolu : 5 10-5 mol écart relatif : 5 10-5 / 2,4 10-3 = 2,08 10-2 soit 2%. dans les résultats deux chiffres après la virgule sont bien suffisants.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
En solution aqueuse, l'acide oxalique est le détecteur du couple CO2,H2O(aq) / C2O4H2 (aq). Lors du dosage d'un volume V2=25,0 mL d'une solution aqueuse de cet acide, l'équivalence est atteinte après addition d'un volume Véq = 10,0 mL d'une solution aqueuse acidifiée de permanganate de potassium, de concentration molaire c1=0,1 mol.L-1.
corrigé
2 fois{ MnO4- + 8 H+ + 5e- donne Mn2+ + 4H2O } réduction 5 fois{ H2C2O4 donne 2 CO2 + 2 H+ + 2e- } réduction 2 MnO4- + 5 H2C2O4 + 6 H+ donne 2 Mn2+ +10 CO2 + 8 H2O l'ion permanganate de couleur violette joue un double rôle : celui de réactif et celui d'indicateur de fin ce réaction. dans le bécher la solution est incolore avant l'équivalence ( excès acide oxalique) puis violette après l'équivalence ( excès d'ion permanganate).
C = 0,1 mol/L. Qté de matière dans 0,1L : 0,01 mol masse molaire acide oxalique H2C2O4 : 2+12*2+16*4 = 90 g/mol m3 = 90*0,01 = 0,9 g.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|