|
tableau d'évolution : méthode graphique En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||
|
|||||||||||||||||||||
|
|
Dans un montage, on remplace un fil uniquequi exerce une tension T en un point A par deux fils exerçant au même point les tensions T1 et T2 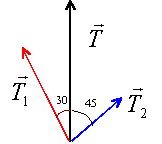
corrigé |
||||||||||||||||||||
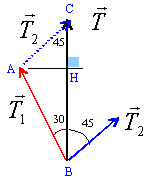
CH =AC cos 45 = AC*0,707 BH = AB cos 30 = AB*0,866 CH+BH = 3,8 (1) AH =CH= BH tan 30 = 0,577 BH repport dans (1) 0,577 BH +BH = 1,577 BH = 3,8 d'où BH = 2,4 et CH = 1,4 AB = 2,4 /0,866 = 2,77 N. AC = 1,4 / 0,707 = 1,98 N |
|||||||||||||||||||||
|
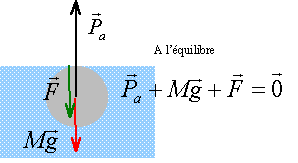
Une boule de rayon r = 5 cm, de masse volumique r, est en équilibre à la surface d'un liquide de masse volumique 0,8 g/ cm3 ou 800 kg /m3. Celle ci est à moitié immergée.
volume d'une sphère : 4/3 pr3.
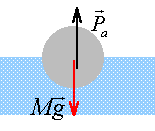
poids = poussée à l'équilibre poids :(N) = masse (kg) *9,8 volume sphère = 4/3 *3,14 * 53 = 523 cm3. masse (g) = volume (cm3) * masse volumique du matériau (g/cm3) 523 r en grammes soit 0,523 r kg. poids (N) = 9,8 *0,523 r=5,125 r. poussée : poids du volume de liquide déplacé volume immergé : 523 /2 = 261,5 cm3. volume immergé (cm3 )* masse volumique du liquide ( 0,8 g/cm3 ) : 261,5 *0,8 = 209,2 g ou 0,209 kg 0,209 * 9,8 = 2,04 N . poids = poussée : 2,04= 5,125 r d'où
r = 0,4 g/ cm3 = 400 kg/m3.
le poids est égal à 2,04 N le volume immergé ayant doublé, la poussée a doublé : 4,08 N F= 4,08-2,04 = 2,04 N.
|
|||||||||||||||||||||
|
On fait réagir, vers 350°C, une mase m = 3,6 g de carbone avec de l'oxyde de cuivre II , de formule CuO. IL se forme du cuivre et du dioxyde de carbone (gaz).
masse atomique molaire en g/mol : C=12 ; O=16 ; Cu=63,5. corrigé 2CuO + C donnent 2Cu + CO2. Quantité de matière de carbone : 3,6 /12 = 0,3 mol
n-2 xmax = 0 d'où n = 0,6 mol masse molaire CuO : 63,5 +16 = 78,5 g/mol masse CuO : 0,6 *78,5 = 47,1 g. volume CO2 gaz : 0,3 *24 =7,2 L. masse de cuivre : 63,5 * 0,6 = 38,1 g.
|
|||||||||||||||||||||
|
Suivi d'une transformation chimique par méthode graphique : Le diagramme représente l'évolution des quantité de matière des espèces chimiques au cours d'une transformation chimique. 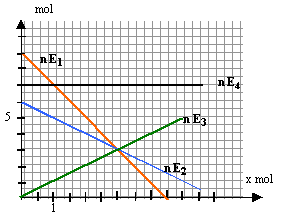
corrigé E4 ne participe pas : le nombre de mole reste constant E1 et E2 réactifs : les quantités de matière diminuent E3 produit : la quantité de matière augmente E1 limitant : il disparaît avant E2. avancement maxi =
4,5 mol ( intersection nE1 avec l'axe des abscisses)
pour E1 : 9/4,5 = 2 . pour E3 : 3 / 3 = 1 . 2E1 + E2 donne E3
|
|||||||||||||||||||||
|
|
|||||||||||||||||||||
|