|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||
|
|
||
|
l'ion éthanolate formé réagit avec l'eau ( réaction 2) pour donner l'éthanol et des ions HO-. Dans 20 mL d'éthanol on introduit 1 g de sodium : une réaction exothermique se produit accompagnée d'un dégagement gazeux important. Quand tout le sodium a disparu, on refroidit le mélage qu'on introduit dans une fiole jaugée de 200 mL contenant un peu d'eau distillée. On complète jusqu'au trait de jauge avec de l'eau distillée et on obtient la solution S. On dose 10 mL de S par une solution d'acide chlorhydrique à 0,1 mol/L. masse volumique éthanol : 790 kg / m3. masse atomique molaire (g/mol) : C=12 ; H=1 ; O=16 ; Na =23. la réaction 1 n'est pas une réaction acide-base car il n'y a qu'un seul couple acide base C2H5OH / C2H5O- mis en jeu. il s'agit d'une réaction d'oxydo-réduction, le sodium est le réducteur. Quantité de matière (mmol) : sodium : 1/23 = 0,0435 mol = 43,5 mmol éthanol : masse = 20 *0,79 =15,8 g 15,8 / 46 =0,343 mol = 343 mmol (excès d'environ 300 mmol) il se forme 43,5 mmol d'ion éthanolate.
base forte : espèce, ion ou molécule susceptible de gagner un proton H+. entièrement ionisée dans l'eau ; la réaction d'une base forte avec l'eau est totale. équation de la réaction (2) : C2H5O- + H2O --> C2H5OH + HO-. deux couples acides bases sont mis en jeu : c'est une réaction acido-basique. C2H5OH / C2H5O- et H2O / HO-.
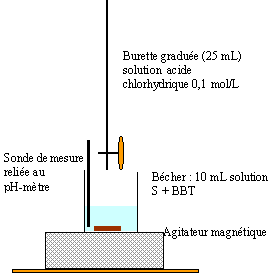
Dosage : On dose 10 mL de (S) par une solution d'acide chlorhydrique. à l'équivalence on a ajouté 21,4 mL d'acide chlorhydrique à 0,1 mol/L l'équivalence peut être repérée à l'aide d'un indicateur coloré dont la zone de virage contient le pH à l'équivalence. dosage acide fort base forte : pHéqui = 7 ; indicateur : bleu de bromothymol. HO- + H3O+ --> 2H2O
à l'équivalence acide base : CaVa = CbVb CaVa = 21,6 *0,1 = 2,16 mmol d'ion HO- dans 10 mL de S soit 2,16*20 = 43,2 mmol ion HO- ( donc d'ion éthanolate) dans 200 mL de S. |
||
|
|