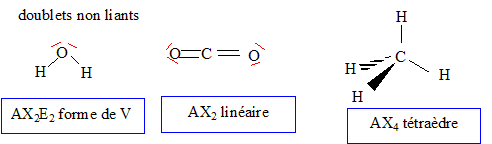|
( d'après Capes 2006) Thermodynamique de la combustion du gaz naturel En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||
| .
. |
|||||||||||
|
|||||||||||
|
CH4(g) + 2 O2(g) = CO2(g) + 2H2O(liq) (1) Structures moléculaires : Les configurations électroniques des atomes H, C et O : H : 1s1 ; C : 1s2 2s2 2p2 ; O : 1s2 2s2 2p4 ; Formules de Lewis pour les molécules d'eau, de dioxyde de carbone et de méthane : La géométrie de ces trois molécules dans le cadre de la méthode VSEPR
Aspects thermodynamiques : On donne les enthalpies standart de
formation à 298 K, en kJ
mol-1. L'enthalpie standard de formation du dioxygène gazeux à 298 K est nulle : Etat standard : état physique sous lequel un corps pur est le plus stable, sous la pression atmosphérique (1 bar) et à une température donnée. Enthalpie standard de formation : variation d'enthalpie accompagnant la formation d'une mole de composé à partir des éléments pris à l'état standard, à une température donnée, très souvant 298K. Valeur de l'enthalpie standard de la réaction (1), notée DrH°1 : DrH°1 = DfH°(CO2) + 2DfH°(H2O) - 2DfH°(O2) - DfH°(CH4) DrH°1 =-393,5 + 2*(-285,8) -(-74,4) = -891 kJ mol-1.
la loi des gaz parfait s'écrit :
p0V=nRT soit n= p0V / (RT) =
105*1/(8,31*298) = 40,4
mol. 40,4 * 891 = 3,6 104 kJ L'air sec est composé de 78 % de diazote, de 21 % de dioxygène et de 1 % d'argon Le volume d'air ( mélange de gaz parfait ontenant 20 % de dioxygène) nécessaire à la combustion de cette quantité n de méthane : CH4(g) + 2 O2(g) = CO2(g) + 2H2O(liq) (1) n(O2) = 2 n(CH4) = 2*40,4 = 80,8 mol. soit encore 2,00 m3 de dioxygène ; donc 10,0 m3 d'air. On appelle tep ( tonne équivalent pétrole) l'unité correspondant à l'énergie libérée par la combustion d'une tonne de pétrole à T=298 K sous la pressio p0. On donne 1 tep = 42 109 J. Masse de méthane dont la combustion dans les mêmes conditions peut libérer une énergie de 1 tep : 1 mole de méthane ( soit 16 g) libère 891 kJ ; 1 kg de méthane libèrera : 891*1000/16 = 5,57 104 kJ = 5,57 107 J 42 109 / 5,57 107 =
754 kg. La combustion du méthane peut également
s'effectuer suivant la réaction de combustion
incomplète traduite par l'équation : - L'énergie libérée est inférieure ( environ 30%) par rapport à la combustion complète. - Dans l'habitat, le monoxyde de carbone est un gaz mortel d'autant plus difficile à détecter qu'il est incolore et inodore. |
|||||||||||
|
0 |
|||||||||||
|
|