|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
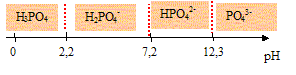
L'acide orthophosphorique H3PO4 est un triacide dont les pKa sont pKa1 = 2,2 ; pKa2 = 7,2 ; pKa3 = 12,3.
corrigé les domaines de prédominance des espèces H3PO4, H2PO4-, HPO42- et PO43- :
Vous désirez préparer 1 L de tampon phosphate 0,05 mol/L à pH=7,2. Vous disposez de NaH2PO4,2H2O d'une puteté de 98 %, de Na2HPO4,12H2O et d'eau distillée. Les étapes nécessaires ainsi que les résultats de calculs éventuels : [H2PO4-] = [HPO42-] Mélanger 0,5 L de solution de NaH2PO4 à 0,1 mol/L et 0,5 L de solution de Na2HPO4 à 0,1 mol/L ; dans le mélange ( facteur de dilution = 2) , les concentrations de chaque ion seront : 0,05 mol/L Quantité de matière (mol) correspondante = volume (L) * concentration (mol/L) : n = 0,1*0,5 = 0,05 mol masse molaire NaH2PO4,2H2O : M= 23+2+31+64+2*18 = 156 g/mol masse (g) = M*n= 156*0,05 = 7,8 g masse à peser, en tenant compte de la pureté : 7,8 / 0,98 = 7,96 g.( dissoudre dans 0,5 L d'eau distillée) masse molaire Na2HPO4,12H2O : M= 46+1+31+64+12*18 = 358 g/mol masse (g) = M*n= 358*0,05 =17,9
g. modère la variation du pH, faisant suite à
l'ajout modéré d'acide ou de base forte.
|
|
|
|
|
|
|