spécialité chimie 3 h
|
|
|
|
|
|
- Donner la formule développée du 3-éthyl-3,4-diméthylhexan-2-ol.
- Proposer une suite de réactions permettant la synthèse du benzoate de benzyle C6H5COO-C6H5 à partir de l'alcool benzilique C6H5-CH2OH comme seul composé organique de départ.
- Le menthol, principal constituant de l'arôme de
menthe a pour formule :
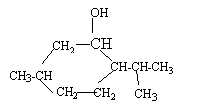
- Quel est le nom systématique sachant que le groupe -CH(CH3)2 peut être appelé isopropyle ?
- Quel est le produit de l'oxydation ménagée du menthol ?
- Le produit obtenu donne-t-il un test positif avec le réactif de Schiff ? avec la DNPH ?
- A partir de 90 g de menthol on a obtenu par action du dichromate de potassium en excès 75 g de produit. Quel est le rendement de la réaction ? - L'éthanoate de 3-méthylbutyle,
noté E, est utilisé en solution alcoolique
comme arôme de poire, dans certains sirops. Ce
liquide a une masse volumique r=
870 kg m-3.
- Ecrire la formule du 3-méthilbutan-1-ol puis celle de E. Quel groupe fonctionnel E possède-t-il ?
- Pour préparer E au laboratoire on fait réagir à ébullition pendant une heure 53 g d'acide éthanoïque avec 33 g de 3-méthylbutan-1-ol en présence d'acide sulfurique. Pouquoi travailler à chaud ? Quel est le rôle de l'acide sulfurique ? - Après purification on recueille 36 mL de E. Quelle est la masse de E obtenue ? La comparer avec celle qu'aurait donné la transformation totale de l'alcool utilisé.
- Le polyéthylène téréphtalate (PET) est un polyester commercialisé sous le nom Tergal, dacron. Ecrire le motif du PET. Repérer le groupe fonctionnel ester.
- Que donne l'action d'une solution de soude concentrée et chaude sur l'éthanoate d'éthyle ?
- Le polyacétate de vinyle (PVAC) est
utilisé dans la fabrication de peinture et vernis.
Indiquer le motif du PVAC. Quel fonction
présente-t-il ? Le PVAC est-il pour autant un
polyester ? Justifier.
Données : C=12 ; H=1 ; O=16 g/mol
corrigé
H3C-CH2-CH(CH3)-C(CH3)(C2H5)-CH(OH)-CH3.
Oxydation ménagée de l'alcool benzilique par le dichromate de potassium en milieu acide : l'alcool primaire donne l'acide benzoïque C6H5-COOH.
Action de l'alcool benzilique sur l'acide benzoïque ( estérification) à chaud en présence d'acide sulfurique comme catalyseur.
2-isopropyl-5-méthylcyclohexan-1-ol
l'oxydation ménagée de la fonction alcool
secondaire donne une cétone : la menthone 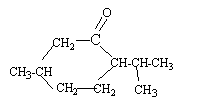
La cétone donne un solide jaune avec la DNPH, mais ne rosit pas le réactif de Schiff, spécifique des aldéhydes.
menthol : C10H20O 156 g/mol ; Qté de matière : 90/156 = 0,577 mol
on peut espérer au plus 0,577 mol de menthone
menthone : C10H18O : 154 g/mol soie en masse : 154*0,577 = 88,8 g.
rendement : masse expérimentale / masse théorique = 75 / 88,8 = 0,84 (84 %).
CH3-CH(CH3)-CH2-CH2OH
E possède un groupe ester : CH3-COO-CH2-CH2CH(CH3)2.
A chaud la réaction est plus rapide ; l'acide sulfurique joue le rôle de catalyseur.
r= 870 kg m-3 = 0,87 g / mL d'où la masse de E : 0,87*36 =31,32 g.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= 0,456 mol |
|
|
|
masse maximale E ( si réaction totale) : 0,375*130 = 48,75 g
rendement : 31,32 / 48,75 = 0,64 (64%)
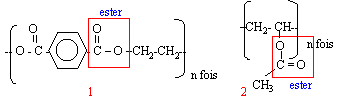
(1) réactions d'estérification entre un acide carboxylique et un alcool d'où polyester
(2) addition sur la double liaison carbone carbone d'où polymère de type vinylique.
CH3-COO-C2H5 + Na+ + HO- --> CH3-COO- + Na+ + C2H5OH
- Quel est le rôle de l'eau dans la mise en solution aqueuse de composés ioniques ou polaires ? Préciser.
- Donner l'équation d'autoprotolyse de l'eau.
Interpreter celle-ci à partir de la structure
électronique de l'eau.
- En vous inspirant de cette équation, écrire les autoprotolyses de l'ammoniac et de l'éthanol purs. - Quatre solutions aqueuses différentes A, B, C,
D se trouvent conservées dans quatre flacons dont
l'étiquette n'est plus lisible. A : solution de
chlorure d'hydrogène à 0,01 mol/L ; B :
solution d'hydroxyde de sodium à 0,01 mol/L ; C :
solution d'ammoniac à 0,02 mol/L ; D : solution de
chlorure de sodium à 0,01 mol/L. On mesure le pH
de chaque solution à 25°C.
- Compléter le tableau suivant :numéro du flacon 1 2 3 4 pH 12 10,6 2 7 solution
- Justifier votre choix. Ecrire l'equation bilan de la réaction chimique s'étant produite avec l'eau au cours de la préparation de chaque solution.
- Quelles expériences simples permettent de mettre en évidence les ions présents dans chaque solution ? - Parmi les indicateurs colorés suivants :
hélianthine [3,1 ; 4,4 ] ; rouge de méthylz [4,4;6,2 ] ; phénolphtaléine [8 ; 9,9 ] ; bleu de bromothymol [6,2 ; 7,6 ]
- Lequel proposeriez vous pour le dosage de l'acide lactique par l'hydroxyde de sodium ? Justifier.
- Au cours du dosage la solution de soude à 0,05 mol/L, placée dans la burette est versée progressivement. les mesures du pH ont permis d'établir le tableau suivant :V(mL) soude 0 2 4 6 8 10 11 11,5 12 12,5 13 14 16 pH 2,6 3,2 3,6 3,9 4,2 4,6 5,2 6,3 8 10,5 11 11,3 11,6 - Citer trois méthodes pour réaliser une solution tampon. Quelles sont les propriétés d'une telle solution ?
corrigé
L'eau détruit l'édifice ionique ; les ions sont dispersés en solution ; les ions s'entourent de molécules d'eau polaires ( hydratation des ions). Dans le cas de molécules polaires, des liaisons hydrogène se forment avec les molécules d'eau.
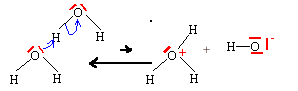
2H2O = H3O+ + HO-. autoprotolyse de l'eau
la réaction inverse est totale : acide fort + base forte
de même : 2 NH3 =NH4+ + NH2-( ions amonium et amidure)
et 2 C2H5OH = C2H5OH2+ + C2H5O- ( ion alcoolate)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l'acide chlorhydrique est entièrement dissocié dans l'eau : pH= -log [acide ] HCl + H2O-->H3O+ + Cl-.
l'ammoniac, base, réagit partiellement avec l'eau NH3 + H2O = NH4+ + HO-.
le chlorure de sodium est entièrement dissocié dans l'eau. NaCl solide= Cl- + Na+ .
mise en évidence des ions ci-dessus :
ion oxonium H3O+ : papier pH devient rouge
ion hydroxyde HO- : papier pH devient bleu
ion chlorure Cl- donne un précipité blanc en présence d'ion argent Ag+.
ion sodium Na+ : test de flamme ( jaune)
ion ammonium NH4+ : chauffé la solution ; un papier imprègné de sulfate de cuivre, placé au dessus de la solution, prend une couleur bleu foncée .
L'équivalence est obtenue pour un volume de soude voisin de 12,2 mL ( saut de pH de 8 à 10). Le pH de la solution à l'équivalence est donc voisin de 8,5. La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent d'où le choix de la phénolphtaléine.
Une solution tampon contient un couple acide base ; les quantités de matière d'acide et de base conjuguée sont identiques.
préparations :
- dosage acide faible base forte avec arrêt à la demi équivalence.( acide éthanoïque et soude (burette))
- dosage base faible acide fort avec arrêt à la demi équivalence.( ammoniac et acide chlorhydrique ( burette))
- mélange de deux solutions : l'un contient l'acide, l'autre la base conjuguée ( acide éthanoïque et éthanoate de sodium)
Un solution tampon modère les variations de pH dues à l'ajout modéré d'acide fort ou de base forte.
Le pH d'une solution tampon ne varie pas par dilution.
- Représenter la formule de Lewis de la molécule.
- On veut rompre par photolyse la liaison entre les
deux atomes d'oxygène.
- Quelles sont les conditions requises pour qu'une molécule de gaz puisse absorber un photon de fréquence n ?
- A quelle relation doit satisfaire un photon de fréquence n pour que son absorption provoque cette rupture ?
- L'énergie de liaison entre les atomes d'oxygène est E=5,144 eV. Calculer la longueur d'onde limite d'une radiation susceptible de dissocier la molécule de dioxygène.
- Dans quelle région du spectre électromagnétique se situe la radiation précédente ? La lumière visible peut-elle entraîner cette dissociation ?
- Proposer un mécanisme de formation de l'ozone O3 qui se produit dand la très haute atmosphère ( détailler les phases).
Données : h = 6,63 10-34 Js ; c = 3 108 m/s ; 1eV= 1,6 10-19 J ; 1 nm = 10-9 m.
corrigé
structure de Lewis dans laquelle on ne représente que les électrons externes de chaque atome
![]()
L'énergie de la molécule est quantifiée (seuls un petit nombre de valeurs est possible) : un photon est absorbé si son énergie est égale à la différence d'énergie entre deux niveaux énergétiques de la molécule ou bien si le photon est suffisamment énrgétique pour rompre une liaison.
E= hn = hc/l
avec h : constante de Plank ; c : célérité de la lumière dans le vide ;l : longueur d'onde (m) ; n fréquence en hertz ; E énergie du photon en joule.
l = hc / E avec E= 5,144*1,6 10-19 =8,23 10-19 J
l = 6,63 10-34*3 108 /8,23 10-19 = 2,41 10-7 m = 241 nm. ( inférieur à 400 nm donc domaine U.V)
Un photon de longueur d'onde inférieure à 241 nm entraîne la rupture de la liaison .
La lumière visible [800 ; 400 nm] ne peut pas entraîner la rupture de la liaison.
Les oxydes d'azote NO et NO2 résultent de la combinaison de l'oxygène et de l'azote, éléments très répandus dans la troposphère ; les réactions qui conduisent à ces oxydes d'azote sont d'origine naturelle (orages, incendies de forêts...) ou induites par les activités humaines (combustion des hydrocarbures, pour le transport ou le chauffage...) La photodissociation du dioxyde d'azote à des longueurs d'onde comprises entre 280 et 430 nm constitue une source possible d'ozone :
NO2 -> NO + O (en présence de rayonnement solaire de courte longueur d'onde),
puis O + O2 -> O3 (en présence d'autres oxydants, sinon, NO2 se reforme : NO + O3 -> NO2 + O2)