|
d'après kiné Hte Normandie 03 |
||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
|
On simule le titrage de 20 mL d'une solution aqueuse d'un acide noté AH, de concentration en soluté apporté CA=10-2 mol/L, par une solution de soude de concentration cB=0,01 mol/L. Le document ci-dessous est le résultat de la simulation. Le logiciel a tracé simultanément : - les variations de pH en fonction du volume de soude versé au cours du titrage. - Les variations des concentrations molaires (en millimoles /L) de l'acide AH et de sa base conjuguée 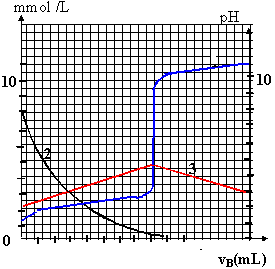
courbe 2 : concentration molaire acide AH courbe 3 : concentration molaire base conjuguée A-. A l'équivalence : quantité de matière d'acide titré : 20*0,01 = 0,2 mmol quantité de matière de soude ajouté : 0,01 vB=0,2 vB= 20 mL correspond à 16 petits carreaux soit 1,25 mL
soude par petit carreau.
lecture courbe 2 à vB=20 mL : [AH]f= 8 mmol L-1 =8 10-3 mol L-1. lecture courbe 3 à vB=20 mL : [A-]f=5 mmol L-1 = 5 10-3 mol L-1. lecture courbe 1 à vB=20 : [H3O+]fvoisin 10-8 mol L-1.( pH voisin de 8) xfin = qté de matière A- = 5 10-3* volume total bécher en litre = 5 10-3 * 0,04 = 2 10-4 mol taux d'avancement final t =
xmax
/ xfin
= 1.
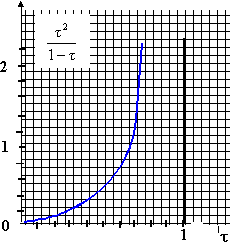
[A-] = [H3O+] = ct ; [AH] = c(1-t ) Ka = (ct )² / (c(1-t ))= ct² / (1-t ) t² / (1-t ) = Ka /c pour une solution plus concentrée, le taux
d'avancement final sera plus petit car la concentration se
trouve au dénominateur dans la relation
précédente ( Ka ne dépend
que de la température).
AH + HO- = A- + H2O lecture graphique à la demi-équivalence du titrage(vB=10 mL): pH=pKa voisin 2,5. Le taux
d'avancement final d'une réaction de titrage est
égal à 1, la réaction étant
totale. [A-] = 9 10-5 / 2,5 10-2 = 3,6 10-3 mol/L. |