|
questions
|
réponses
|
|
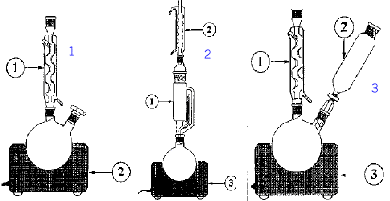
La première fonction d'une
alimentation stabilisée est
d'abaisser la tension
u1 délivrée par le
secteur . Représenter le symbol
d'un transformateur parfait.
|

|
|
Préciser les caractéristiques
de la tension délivrée par le secteur
: forme, fréquence, période, valeur
efficace.
|
tension alternative sinusoïdale, de
fréquence 50 hz, de période T=1/50 =
0,02 s = 20 ms, de valeur efficace 220 V.
|
|
Le transformateur utilisé
délivre une tension u2 de valeur
efficace 6V. Que vaut le rapport de transformation
m ?
|

m = 6/220 =
0,027.
|
|
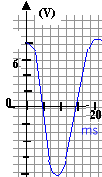
Repésenter l'oscillogramme de la
tension u2 si les sensibilités
sont : 5 V/div ; 2 ms / div.
|
|
|
La deuxième fonction est
le redressement
réalisé par un pont de Graetz. Quels
sont les dipoles mis en oeuvre dans cette fonction
?
|
4 diodes
|
|
Représenter le schéma du pont
redresseur. Expliquer le fonctionnement du pont
redresseur en fermant le circuit sur une
résistance R et en précisant le sens
du courant pour chaque alternance.
|
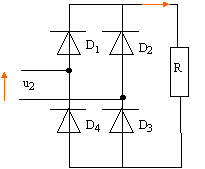
première alternance : D1, puis
R , puis D3.
seconde alternance : D2, puis R ,
puis D4.
|
|
Pour visualiser la tension redressée
u3 on dispose d'un rhéostat
réglé sur 10 W
et supportant 2,5 A et d'un conducteur ohmique de
résistance 10 W -
1W. Lequel de ces deux éléments
doit-on utiliser. Justifier. ( les diodes sont
idéales, c'est à dire que leur
tension de seuil est nulle)
|
conducteur ohmique de résistance 10
W - 1W. La tension aux
bornes de ce conducteur est 6 V : la puissance
absorbée sera : u² / R = 6*6 / 10 = 3,6
W, valeur bien supérieure à la
puissance admissible 1W.
rhéostat
réglé sur 10 W
|
|
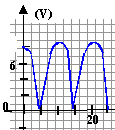
Repésenter l'oscillogramme de la
tension u3 si les sensibilités
sont : 5 V/div ; 2 ms / div.
|
|
|
Filtrage de la
tension redressée : on utilise
pour filtrer la tension redressée
u3 un condensateur
électrochimique : C= 2200 mF-Umax
= 20 V. Quelles précautions faut-il prendre
lorsqu'on utilise un tel condensateur ?
|
ne pas dépasser la tension maximale
le condensateur est polarisé :
relié l'extrémité notée
"moins" à la masse du montage
|
|
Indiquer le branchement du condensateur de
filtrage et de la résistance de charge R.
|
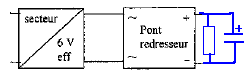
|
|
Représenter approximativement pour
les valeurs de R et C précédentes,
l'allue de la tension filtrée u4
si les sensibilités sont : 5 V/div ; 2 ms /
div.
|
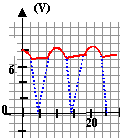
|
|
Régulation
de la tension filtrée
u4 : quel composant électronique
utilise-t-on pour obtenir à partir de
u4 une tension continue U5=
5V ?
|
diode Zener de tension inverse
uZ=5 V
|
Etude d'une
lentille mince convergente
|
|
Construction de
l'image donnée par une lentille mince
convergente : la lentille a une distance
focale f'=10 cm.
ce qui est écrit
en gras et en bleu est une grandeur
algébrique.
On considère un
objet
AB=
5 cm placé devant la lentille tel que
OA=
- 5 cm. Représenter le symbole d'une
lentille convergente et construire l'image
A1B1
de l'objet.
|
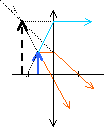
la lentille fonctionne en
loupe car l'objet est entre la lentille et le foyer
principale objet.
|
|
Déterminer par calcul la position de
l'image
OA1
à partir de la relation de
conjugaison.
|
1/f ' = 1 /
OA1
- 1/OA
soit :
1 /
OA1
=1/f ' +1/OA
= 1/0,1 +
1/(-0,05)
1 /
OA1
= 10-20 = -10 et
OA1
= -0,1
m.
|
|
Déterminer par calcul le
grandissement g1.
|
g1 =
OA1
/ OA
= -0,1 / -0,05 =
2
|
|
Commenter l'image obtenue et donner une
application simple de ce dispositif.
|
image virtuelle, deux fois plus grande que
l'objet, de même sens que l'objet.
la lentille fonctionne en loupe.
|
|
On considère
un objet
AB=
5 cm placé devant la lentille tel que
OA=
- 15 cm. Construire l'image
A1B1
de l'objet.
|
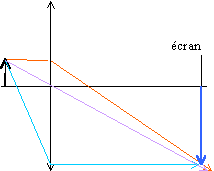
|
|
Déterminer par calcul la position de
l'image
OA1
à partir de la relation de
conjugaison.
|
1/f ' = 1 /
OA1
- 1/OA
soit :
1 /
OA1
=1/f ' +1/OA
= 1/0,1 +
1/(-0,15)
1 /
OA1
= 10-6,67 = 3,33 et
OA1
= 0,3
m.
|
|
Déterminer par calcul le
grandissement g1.
|
g1 =
OA1
/ OA
= 0,3 / -0,15 =
-2
|
|
Commenter l'image obtenue et donner une
application simple de ce dispositif.
|
image réelle, deux fois plus grande
que l'objet, de sens que contraire à
l'objet.
projecteur diapo.
|
|
focométrie
: la méthode de Silbermann permet de
déterminer la distance focale d'une lentille
convergente . Cette méthode consiste
à obtenir une image réelle de
même taille que celle de l'objet.
Déterminer sur un schéma la
position de l'objet pour que la condition ci-dessus
soit réalisée . ( f ' = 5 cm ;
échelle 1/5 )
|
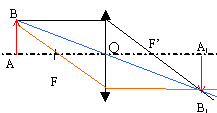
|
|
En déduire la relation entre la
distance objet-image et la distance focale f '.
|
f ' = 0,25 distance objet-image
|
|
Avec une autre lentille convergente, cette
méthode donne distance objet-image = 50 cm.
Donner la valeur de f ' et la vergence C de la
lentille en précisant
l'unité.
|
f ' = 0,25 *50 = 12,5 cm = 0,125 m
C= 1/ 0,125 = 8 dioptries
|
|
Chimie : dosage
acido-basique
|
|
On se propose de préparer puis
d'étalonner une solution d'acide sulfurique
grâce à un dosage acide base
réalisé avec le borax
(tétraborate de sodium)
Préparation de
la solution d'acide sulfurique : on
souhaite préparer une solution de
concentration c= 0,01 mol/L.
On dispose d'acide sulfurique concentré
dont les caractèristiques sont les suivantes
:
pureté : 96 % en masse ; densité d
=1,84 ; masse molaire 98 g/mol.
Calculer le volume d'acide sulfurique à
prélever pour préparer 1 L de
solution à 0,01 mol/L
|
masse de 1 L : 1840 g
masse d'acide pur dans 1 L : 1840*0,96 = 1766,4
g
Quantité de matière d'acide
(mol)
= 1766,4 / 98 = 18 mol/L
facteur de dilution : 18 / 0,01 = 1800
volume à prélever : 1 / 1800 =
0 , 55
mL
|
|
Quel ustensile utilise-t-on pour ce
prélevement ?
|
pipette graduée + pipeteur
|
|
Quels sont les points importants à
respecter du point de vue de la
sécurité pour effectuer cette
préparation ?
|
travailler sous hotte
lunette et gants
verser l'acide pur dans l'eau distillée
et non pas l'inverse
|
|
Préparation
de la solution de borax :
Na2B4O7, 10
H2O masse molaire 381, 37 g/mol. On
prépare 100 mL d'une solution étalon
après avoir pesé 0,381 g de borax.
Quelle est la concentration de cette solution
?
|
Qté de matière de borax :
0,381 / 381,4 = 10-3 mol
concentration : 10-3 / 0,1 =
0,01
mol/L
|
|
Dosage:
l'ion borate est une base faible qui réagit
sur l'eau suivant :
B4O72- +
7H2O= 4H3BO3 +
2HO-.
Ecrire la réaction entre l'acide
sulfurique et le borax.
|
B4O72- +
2H3O+ +3H2O -->
4H3BO3
|
|
Le dosage s'effectue de la façon
suivante : acide sulfurique dans la burette ; 10 mL
de la solution de borax dans un bécher ;
quelques gouttes d'indicateur coloré ; on
ajoute goutte à goutte l'acide sulfurique
jusqu'au virage. L'opération est
effectuée 3 fois eton obtient les volumes
suivants : 9,950 ; 9,925 ; 9,950 mL. Sachant que la
réaction se fait mole à mole trouver
la concentration de l'acide sulfurique.
|
[acide sulfurique]= 10*0,01 / 9,94
= 0,01
mol/L
|
Choix de
l'indicateur coloré : l'acide
borique H3BO3 obtenu à
l'équivalence est un acide faible. Quel
indicateur coloré choisir dans la liste
suivante ? Quel sera le changement de couleur
observé ?
bleu de thymol [1,2 - 2,7 ] rouge jaune
rouge de méthyle [4,4 - 6,2 ]
rouge jaune
tournesol [5 - 8 ] rouge bleu
rouge de crésol [7,3 - 8,8] jaune
rouge
phénolphtaléine [8,3 - 10
] incolore rose
|
l'acide borique H3BO3
est présent à l'équivalence :
le pH est donc inférieur à 7
la zone de virage de l'indicateur coloré
doit contenir le pH à
l'équivalence.
rouge de
méthyle.
la couleur passe du jaune au rouge dans le
bècher ( après l'équivalence
l'acide sulfurique est en
excès)
|
|
|
|