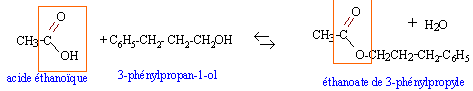|
kiné Limoges 2002 |
|||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
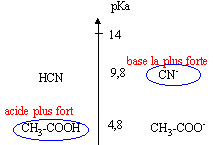
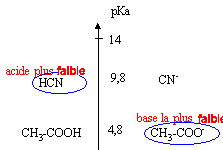
Considérons un litre de solution obtenue en dissolvant dans l'eau 0,3 mole d'acide éthanoïque, 0,2 mole d'hydroxyde de sodium, 0,05 mole de cyanure de potassium KCN, solide ionique totalement dissocié et 0,2 mole d'éthanoate de sodium.
corrigé 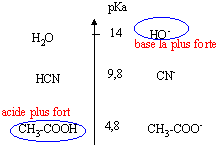
CH3COOH + HO- --> CH3-COO- + H2O RP1. K1 = [CH3-COO-] /([CH3COOH ][HO-])=[CH3-COO-][H3O+] /([CH3COOH ][HO-][H3O+]) K1 = 10-4,8 / 10-14 = 109,2 valeur très grande donc réaction totale.
CH3COOH + CN- --> CH3-COO- + HCN RP2. K2 = [CH3-COO-] [HCN]/([CH3COOH ][CN-])=[CH3-COO-][H3O+][HCN] /([CH3COOH ][CN-][H3O+]) K2 = 10-4,8 / 10-9,8 = 105 valeur très grande donc réaction totale.
CH3-COO- + HCN -->CH3COOH + CN- RP3. K3 = 1/ K2 = 10-5 ( réaction inverse de la précédente) K3 = 10-5 valeur très faible donc réaction très limitée. le couple acide éthanoïque/ ion éthanoate fixe le pH soit : pH = pKa1 + log[CH3-COO-] / [CH3COOH] pH = 4,8 + log(0,45 / 0,05 ) = 4,8 + log 9 = 4,8 +0,95 = 5,75.
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
On fait réagir 0,46 g de sodium pur avec 100 mL d'éthanol absolu qui est alors en excès. Il se forme du dihydrogène, des ions éthanolate et des ions sodium.
masse atomique molaire en g/mol : H=1 ; C=12 ; Na = 23 ; O= 16 ; log 2 = 0,3 corrigé alcool absolu : alcool éthylique pur. C2H5OH + Na --> C2H5O- + ½H2 + Na+. Qté de matière de sodium= Qté de matière d'ion éthanolate = 0,46 / 23 = 0,02 mol couples acide / base : C2H5OH / C2H5O- ; H2O / HO-. C2H5O- + H2O --> C2H5OH + HO-. Qté de matière d'ion hydroxyde = Qté de matière d'ion éthanolate = 0,02 mol dans 0,1 L soit [HO-]=0,2 mol/L le facteur de dilution est égal à : 500 / 100 = 5 donc après dilution [HO-]=0,2 / 5 = 0,04 mol/L pH = 14 + log 0,04 = 12,6. |
|||||||||||||||||||||||||||||||||||||||||||||||
|
L'acétate de 3-phénylpropyle, noté E par la suite, est utilisé comme " note muguet " dans certains parfums.
Le chauffage à reflux permet de travailler à température moyenne ( accélération de la réaction) et évite les pertes de matière. L'acide sulfurique est un catalyseur. Qté de matière initiale d'acide : 1 mol Qté de matière initiale d'alcool : 68 / 136 = 0,5 mol ( en défaut) Qté théorique d'ester : 0,5 mol masse d'ester : 0,5 * 178 ( masse molaire ester) = 89 g rendement = Qté réelle / Qté théorique = 35,6 / 89 = 0,4 ou 40%.
retour - menu |