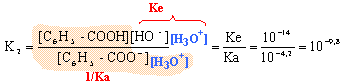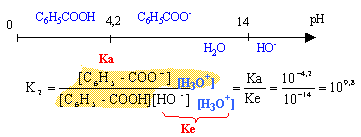|
( concours kiné EFOM 02) |
|||
|
|||
|
On étudie le couple acide benzoïque / ion benzoate C6H5COOH / C6H5 COO-. pKa = 4,2
C6H5COOH +H2O équilibre avec C6H5 COO- + H3O+. K1 = [C6H5 COO-
][H3O+] /
[C6H5COOH ] = Ka =
10-4,2 = 6,3
10-5.
C6H5COOH +HO- équilibre avec C6H5 COO- + H2O.
la réaction entre l'acide benzoïque et la
soude est totale, la constante de réaction
étant très grande.
[C6H5 COOH] = 0,01*0,01 = 10-4 mol , la réaction de lacide benzoïque avec l'eau étant négligeable. [C6H5 COO-] = [C6H5 COOH] donc pH=pKa=4,2.
retour - menu |