|
sage
femme Ile de
France
2001
|
|||
|
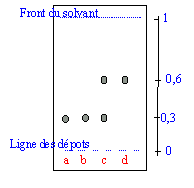
On introduit dans un erlenmeyer 6,54 g de para-aminophénol HO-C6H4-NH2, 50 mL d'eau et 3,5 g d'acide éthanoïque. L'ensemble est chauffé au bain marie pour dissoudre le para-aminophénol solide. Après avoir refroidi le mélange, on ajoute lentement 7 mL d'anhydride éthanoïque. On constate un échauffement de l'erlenmeyer. Lorsque le milieu réactionnel est revenu à température ambiante, on place l'erlenmeyer dans la glace. Un solide blanc apparaît. Il est isolé par filtration sur büchner. Le solide blanc est lavé à l'eau glacée.Il est dissout dans le minimum d'eau contenue dans un erlenmeyer. La solution est portée à ébullition puis refroidie. L'erlenmeyer est placé dans la glace jusqu'à recristallisation complète. Après filtration, le solide est séché à l'étuve. On a obtenu 6,4 g de paracétamol. On réalise une CCM ( chromatographie sur couche mince de silice). On dépose les échantillons sur la ligne de base : (a) du paracétamol pur ; (b) le produit blanc obtenu recristallisé ; (c) le produit blanc obtenu avnt recristallisation ; (d) du para-aminophénol. Après élution, la révélation du chromatogramme montre une seule tache pour (b) et deux taches pour (c). Les échantillons (a) et (d) présentent un rapport frontal Rf respectivement égal à 0,3 et 0,6. questions :
données : masse volumique anhydride éthanoïque : 1,08 g/mL ; masse atomique molaire en g/mol : C=12 ; H=1 ; O=16 ; N=14.
|
|||
|
l'anhydride éthanoïque réagit avec la fonction amine possédant le caractère nucléophile le plus fort. (CH3-CO)2 O + HO-C6H4-NH2 donne CH3-COOH + HO-C6H4-NH-CO-CH3 Quantités de matière des réactifs : anhydride éthanoïque : 7 *1,08 = 7,56 g masse molaire : 12*4 + 6+3*16 = 102 g/mol 7,56 / 102 = 0,074 mol.(excès) para-aminophénol : masse molaire : 12*6+7+16+14 = 109 g/mol 6,54 /109 = 0,06 mol hydrolyse se l'anhydride éthanoïque en excès : on obtient l'acide éthanoïque (CH3-CO)2 O + H2O donne 2 CH3-COOH la trompe à eau crée une dépression dans le récipient situé sous le filtre : cela accélère le passage du liquide à travers le filtre. La filtration est plus rapide. la recristallisation permet de purifier le paracétamol : on utilise la différence de solubilité du paracétamol et des impuretés dans un solvant approprié. Pour cela on dissout à chaud, dans le minimum de solvant le paracétamol impur puis on laisse refroidir. La solubilité diminue beaucoup avec la température. Le paracétamol cristallise à froid et les impuretés restent dans le solvant si celui ci est convenablement choisi. rendement : masse molaire du paracétamol : 8*12+9+14+2*16 = 151 g/mol à partir de 0,06 mol de para-aminophénol on peut théoriquement obtenir 0,06 mol de paracétamol soit : 151*0,06 = 9,06 g. rendement = masse expérimentale * 100 / masse théorique = 6,4 /9,06 *100 = 70,6 %.
la chromatographie permet de séparer et d'identifier les constituants d'un mélange. Après recristallisation le produit (le paracétamol) est pur. La révélation est nécessaire, chaque fois que les produits ou réactifs sont incolores. Le révélateur agit avec les molécules situées sur le chromatogramme pour conduire à d'autres produits colorés. Dans le cas de molécules possédant des noyaux benzéniques, l'exposition à la lumière UV rend les taches visibles ( si la plaque CCM est sensible aux UV). analgésique : supprime la sensibilité à la douleur. antipyrétique : qui fait tomber la fièvre.
retour - menu |