|
concours kiné A P Paris /01.
|
|||
corrigé |
|||
|
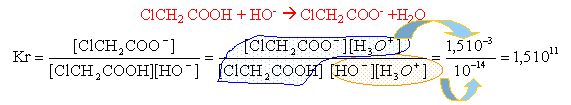
réaction de dosage acide base, réaction totale la constante Kr est grande
A l'équivalence les quantités de matière d'acide chloroéthanoïque et d'ion hydroxyde sont en proportions stoéchiométriques. la base conjuguée de l'acide, ion chloroéthanoate est majoritaire, donc le pH sera supérieur à 7. l'autre espèce majoritaire est l'ion sodium, apporté par la soude. le pH de l'équivalence doit être situé dans la zone de virage de l'indicateur coloré: d'où le choix de la phénolphtaléine. concentration de l'acide : CaVa=CbVb à l'équivalence Ca= 12,5 * 0,08 / 10 =0,1 mol/L. coefficient de dissociation : pour un acide faible : pH= pKa + log [A-] / [AH] pKa = -log (1,5 10-3 ) =2,82 d'où log [A-] / [AH] = 2 - 2,82 = -0,82 [A-] / [AH] = 10 -0,82 =0,15 soit [A-] = 0,15 [AH] conservation de la quantité de matière : [A-] + [AH] = 0,1 0,15 [AH] +[AH] = 0,1 [AH] = 0,1/ 1,15 = 0,087 mol/L [A-] = 0,1 -0,087 = 0,013 coefficient de dissociation a = [A-] / C =0,013 / 0,1 = 0,13. valeur de Ka : la solution est électriquement neutre et en mileu acide (pH voisin de 2) HO- minotitaire [A-] + [ HO- ] = [H3O+] d'où [A-] voisin [H3O+] voisin 0,01 mol/L et [AH] voisin 0,1-0,01 = 0,09 mol/L Ka = [H3O+][A-] / [AH] Ka voisin de : 10-2 *10-2 / 0,09 =1,1 10-3 .
retour - menu |