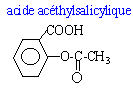|
kiné
Limoges 04/
01
|
|||
|
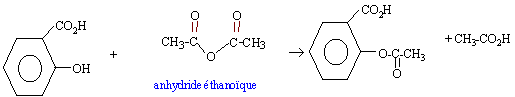
Le composé actif d'un
médicament est l'acide acéthysalicylique qui
peut être obtenu par l'action de l'acide
2-hydroxybenzoïque sur l'anhydride
acétique.
|
|||
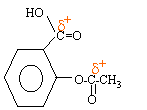
l'atome de carbone du groupe ester et celui du groupe acide carboxylique sont déficitaires en électrons : ce sont des sites électrophiles, porteurs de la charge positive d+ inférieure à la charge élémentaire.
la réaction de dosage acide base, de constante K, s'écrit : C9H8O4 + HO- --> C9H7O4- + H2O
La constante K est
supérieure à 5000, la réaction du
dosage est totale.
donc rouge de crésol. A l'équivalence les quantités d'acide et de base mis en présence sont dans les proportions stoéchiomètriques CaVa = CbVb avec Cb = 0,1 mol/L ; Vb = 7 mL ; Va = 100 mL Ca = 0,1*7 /100 = 7 10-3 mol/L. soit 7 10-3 *0,25 = 1,75 10-3 mol dans 250 mL masse = 1,75 10-3 *180 = 0,315 g = 315 mg.
retour - menu |