La combustion du carbone nécessite du
dioxygène et produit du dioxyde de carbone.
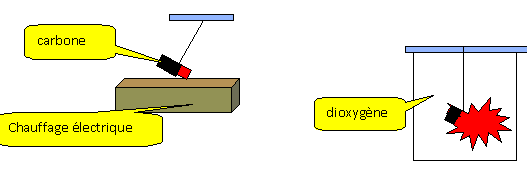
On place un morceau de carbone rougi dans du
dioxygène : le carbone disparaît ; il brule
avec éclat dans le dioxygène.
Le gaz formé est aspiré à l'aide
d'une seringue et placer dans un tube à essai
contenant de l'eau de chaux.
L'eau de chaux se trouble
Test du dioxyde de carbone : en présence de
dioxyde de carbone, l'eau de chaux donne un
précipité blanc.
|
Etat initial ( réactifs)
|
état final ( produit)
|
|
carbone ( le combustible)
|
dioxyde de carbone
|
|
dioxygène ( le comburant)
|
Les espèces initiales sont différentes des
espèces finales : une transformation chimique a eu
lieu.
Elle porte le nom de
combustion.
Cette transformation chimique peut être traduite
à l'aide d'une équation :
Carbone + dioxygène -->
dioxyde de carbone.
|
Une combustion nécessite la
présence de réactifs (combustible et
comburant) qui sont consommés au cours de la
combustion ; un (ou des) nouveau(x) produit(s) se
forme(nt).
|
La combustion du butane et/ou du
méthane, d'une bougie, dans l'air nécessite du
dioxygène et produit du dioxyde de carbone et de
l'eau.
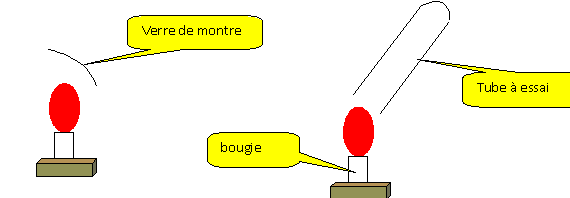
La partie froide du verre de montre
se couvre de buée : la combustion de la bougie
produit de l'eau.
Recueillir les gaz issus de la
combustion de la bougie dans un tube à essais.
Ajouter dans ce tube 2 mL d'eau de chaux. Boucher et
agiter.
L'eau de chaux se trouble : la
combustion de la bougie produit du dioxyde de
carbone.
|
Etat initial ( réactifs)
|
état final ( produit)
|
|
bougie ( le combustible)
|
dioxyde de carbone
|
|
dioxygène ( le comburant)
|
eau
|
Les espèces initiales sont différentes des
espèces finales : une transformation chimique a eu
lieu.
Cette transformation chimique peut être traduite
à l'aide d'une équation :
bougie + dioxygène -->
dioxyde de carbone + eau.
La combustion du fer dans le
dioxygène.
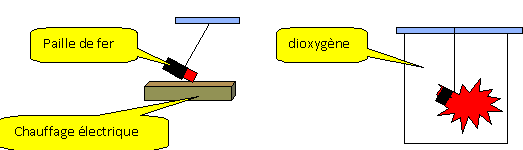
On place un morceau de paille rougi dans du
dioxygène : le fer disparaît ; il brule avec
éclat et étincelle dans le
dioxygène.
- On obtient un solide gris après combustion.
- Le gaz formé est aspiré à l'aide
d'une seringue et placer dans un tube à essai
contenant de l'eau de chaux.
L'eau de chaux ne se trouble pas : la combustion ne
produit pas de dioxyde de carbone.
- Tester la présence de dioxygène dans le
récipient après combustion à l'aide
d'une allumette rougie : l'allumette ne se rallume pas :
absence dedioxygène.
|
Etat initial ( réactifs)
|
état final ( produit)
|
|
fer ( le combustible)
|
oxyde de fer
|
|
dioxygène ( le comburant)
|
|
Les espèces initiales sont différentes des
espèces finales : une transformation chimique a eu
lieu.
Cette transformation chimique peut être traduite
à l'aide d'une équation :
fer + dioxygène --> oxyde de
fer.
|
Compléter
les phrases suivantes :
La ……… du carbone dans le
dioxygène est vive. Dans cette
réaction ………, le carbone est
le ………Les deux
…………disparaissent ; il y a
formation d'un …………
nommé ……………
. L'air est composé essentiellement de
……… et en quantité moindre de
…………Le .....joue le rôle
de comburant.
La
combustion du
carbone dans le dioxygène est vive. Dans
cette réaction
chimique, le
carbone est le
combustible.
Les deux
réactifs
disparaissent ; il y a formation d'un
produit
nommé dioxyde de
carbone.
L'air est composé essentiellement de
diazote et en
quantité moindre de
dioxygène
; le dioxygène
joue le rôle de comburant.
La combustion complète de 9 g de carbone il
faut 24 g de dioxygène ( ou bien 18 litres
de dioxygène mesurés dans les
conditions normales de température et
pression).
Quelle masse de
dioxygène faut-il pour brûler
complètement 15 g de carbone
?
Masse de dioxygène nécessaire
à la combustion complète de 1 g de
carbone :
24/9 = 2,67 g.
Masse de dioxygène nécessaire
à la combustion complète de 15 g de
carbone :
2,67 *15 =
40
g.
Quel volume de
dioxygène faut-il alors utiliser
?
Volume de dioxygène nécessaire
à la combustion complète de 1 g de
carbone :
18/9 = 2 L.
Volume de dioxygène nécessaire
à la combustion complète de 15 g de
carbone :
2 *15 = 30
L.
Quelle masse de carbone
peut-on faire brûler complètement dans
96 g de dioxygène ?
96 / 24 = 4 puis 9*4 =
36 g de
carbone.
Quel est le volume de
dioxygène nécessaire ?
18*4 = 72
L.
Quel volume d'air est
alors nécessaire ?
L'air contient en volume 20 % de
dioxygène.
72 / 0,2 =
360 L
d'air.
|


