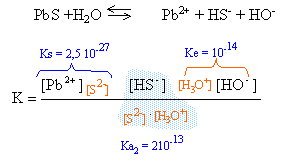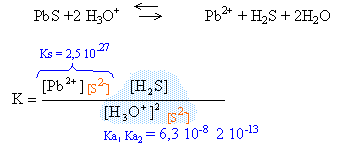|
|
||
|
||
|
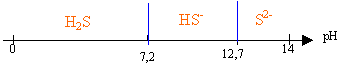
Le sulfure de plomb est un composé peu soluble pKs = 26,6. On donne pKa1( H2S aq / HS- ) = 7,2 et pKa2( HS- / S2- ) = 12,7
|
||
|
la forme acide AH prédomine à pH < pKa la forme base conjuguée A- prédomine à pH> pKa et [AH]= [A-] à pH=pKa
à pH =14 l'ion S2- est majoritaire, HS- est minoritaire et H2S est ultraminoritaire. [Pb2+] voisin [S2-] et Ks = [Pb2+] [S2-] = 10 -26,6 = 2,51 10-27 . s= [Pb2+] = racine carrée (2,51 10-27) = 5,01 10-14 mol/L. à pH=9 l'espèce majoritaire est HS-.
K= Ks Ke / Ka2 = 2,5 10-27 10-14 / 2 10-13 = 1,25 10-28 . d'après l'équation ci dessus il se forme autant d'ion Pb2+ que d'ion HS- donc : [Pb2+]=[HS-]= s [HO-] = 10-5 à pH=9 1,25 10-28= s² 10-5 d'où s = 3,53 10-12 mol/L. à pH =1 l'espèce majoritaire est H2S.
K= Ks / (Ka1 Ka2 ) = 2,5 10-27 / (12,3 10-21 ) = 2 10-7 . d'après l'équation ci dessus il se forme autant d'ion Pb2+ que de H2S donc : [Pb2+]=[H2S]= s [H3O+] = 10-1 à pH=1 2 10-7 = s² / [H3O+]² d'où s = 4,4 10-5 mol/L
retour - menu |