|
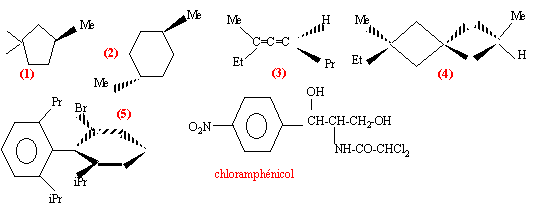
quelles sont les molécules chirales ? |
||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
corrigé |
||||||||||||||||||||||||||||||||
|
(2) possède deux carbones asymétriques, et un centre de symétrie : molécule non chirale . (3) (isomèrie allénique) pas de carbone asymétrique, mais cette molécule ne possède aucun élément de symétrie molécule asymétrique chirale, non superposable à son image dans un miroir. (4) (isomèrie spirannique) pas de carbone asymétrique, mais cette molécule ne possède aucun élément de symétrie les deux cycles sont dans des plans orthogonaux car le carbone commun aux deux cycles est tétragonal molécule asymétrique chirale, non superposable à son image dans un miroir. (5) (isomèrie atopique) pas de carbone asymétrique mais les substituants Br et iPr sont très volumineux et interdissent toute rotation autour de la liaison simple C-C molécule asymétrique chirale, non superposable à son image dans un miroir.
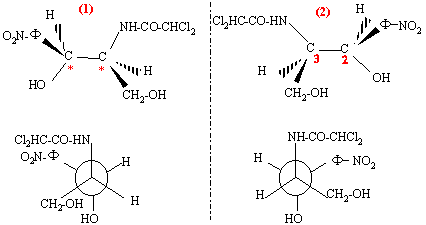
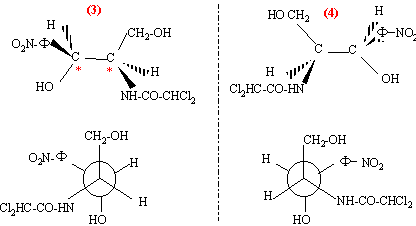
chloramphénicol : n = 2 atomes de carbone asymétriques ( atome de carbone tétraèdrique possèdant 4 substituants différents) on prévoit 2n = 2 ² = 4 stéréoisomères prévus.
l'ordre de préséance est le suivant :( ordre de n° atomique décroissant) pour le carbone n°2 : -NH-CO-CHCl2 > carbone n° 3 > CH2OH >H pour le carbone n°3 : -OH > C6H5NO2 > CH2OH >H on regarde dans la direction C*-->4 : si la succession des substituants 1-->2-->3 se fait dans le sens des aiguilles d'une montre, le composé est dit R d'où les configurations absolues : (figure 1) : 2S, 3S ; (figure 2) : 2R, 3R ; (figure 3) : 2R, 3S ;( figure 4) : 2S, 3R
|
||||||||||||||||||||||||||||||||
|
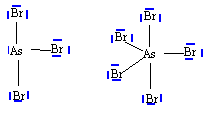
numéro atomique O : Z=8 ; As : Z=33 ; Br : Z=35. corrigé N, P, As appartiennent à la même famille; ils possèdent le même nombre d'électrons externes sur la couche de valence. Ils ont 3 électrons célibataires et peuvent former 3 liaisons de covalence. L'énergie de première ionisation est égale à l'enthalpie de la réaction suivante : X (gaz) --> X+ (gaz + e-. Cette énergie étant fonction de 1/ n* ² diminue donc de N à As. le rayon atomique r = n* ² a0 / Z* augmente avec n de N à As. schéma de Lewis :
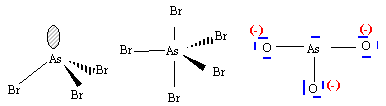
Le phosphore dispose d'orbitale 3d vacantes, il peut donner deux composés halogénés. L'azote ne peut avoir au plus que 8 électrons sur sa couche de valence : donc un seul type de dérivé halogéné. géomètrie des molécules : AsBr3 : As atome central ; 3 liaisons de covalence ; un doublet non liant donc type AX3E structure pyramydale à base triangulaire AsBr5 : As atome central ; 5 liaisons de covalence donc type AX5. forme bipyramidale trigonale.
ion arsénite AsO33- : pas de formule mésomère limite. liaison As--O localisées entre les atomes
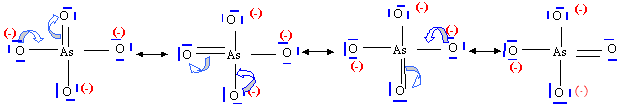
ion arséniate AsO43- : 4 formes mésomères limites, 4 liaisons équivalentes les électrons de liaisons sont délocalisés, d'où une longueur de liaison As--O plus grande que dans l'ion arsénite. |