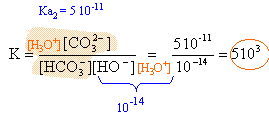|
carbonate et hydrogénocarbonate |
||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
|
Une solution d'hydrogénocarbonate de sodium NaHCO3 a une fraction massique de 6,00 % et une masse volumique égale à 1,0408 g.cm3.
Na=23 ; C=12 ; 0=16 ; H=1 g/mol Constantes d'acidité à 25°C : pKa(H2O,CO2/HCO3 -)=pKa1=6,4 ; pKa(HCO3 -/CO3 2-)=pKa2=10,3 corrigé |
||||||||||||||||||||||||||||||||
|
1040,8 fois 0,06 donne 62,45 g hydrogénocarbonate de sodium masse molaire NaHCO3: 23+1+12+48 = 84g/mol concentration : 62,45/84 = 0,743 mol dans 1 L . molalité : masse du soluté / masse du solvant molalité = 62,45 / (1040,8-62,45) =6,38 10-2. fraction molaire x =1 ( un seul
soluté)
c'est l'acide du couple HCO3 -/CO3 2- c'est la base du couple H2O,CO2/HCO3 - Le pH sans doute voisin de 0,5
(pKa1 + pKa2 ) soit
8,35
.
on note : H2A le diacide H2O,CO2 ; HA- l'ampholyte HCO3 - ; A2- la base CO3 2- h =[H3O+] et w =[HO-] conservation de l'élément carbone : [HA-]+[H2A] +[A2-]=0,743 (1) . solution électriquement neutre : NaHCO3 entiérement ionisé en ion Na+ et HCO3 - donc [Na+] =0,743 mol/L [Na+] + h = 0,743 + h = [HA-] + w +2[A2-] on peut négliger h et w devant les concentrations des autres espèces 0,743 voisin [HA-] +2[A2-] (2) (1) et (2) donnent : [H2A] = [A2-] constante d'acidité : Ka1 = 4 10-7 = [HA-] h / [H2A] (3) Ka2 = 5 10-11 =[A2-] h / [HA-] (4) faire le produit des constantes d'acidité : 2 10-17 = h² [A2-] / [H2A] or [H2A] = [A2-] d'où h² = 2 10-17 et pH =8,35 . vérifions notre hypothèse : h= 4,5 10-9 mol/L et w = 10-14 / 4,5 10-9 = 2,23 10-6 mol/L (3) donne [H2A] = [HA-] h / 4 10-7 = 0,0125 [HA-] (4) donne [A2-] = [HA-] 5 10-11 / h = 0,0111 [HA-] repport dans (1) : [HA-] (1+0,0125+0,0111)=0,743 [HA-] =0,726 mol/L par suite : [H2A] = 9,07 10-3 mol/L [A2-] =8,06 10-3 mol/L
|
||||||||||||||||||||||||||||||||
|
Une solution S contient un mélange d'ions carbonate CO32- et hydrogénocarbonate HCO3-. Son pH vaut 10,1 et [CO32-] =1,3.10-3 mol.L
-Donner l'équation-bilan de la réaction prépondérante à considérer et calculer sa constante thermodynamique -Calculer le nouveau pH pour n=10-4 mol -Calculer le nouveau pH pour n=10-3 mol Constantes d'acidité à 25°C : pKa(H2O,CO2/HCO3 -)=pKa1=6,4 ; pKa(HCO3 -/CO3 2-)=pKa2=10,3 corrigé pH=pKa + log [CO32-] / [HCO3-] 10,1 = 10,3 + log [CO32-] / [HCO3-] donne [CO32-] / [HCO3-] =10-0,2 = 0,63 [HCO3-]=1,3
10-3 /0,63 = 2,06
10-3 mol/L
la réaction est pratiquement quantitative. dans 0,2 L il y a 1,3 10-3 *0,2 = 2,6 10-4 mol CO32- et 2,06 10-3 *0,2 = 4,12 10-4 mol HCO3- initialement
avancement maximal : 0,1 -xmax =0 d'où xmax =0,1 mmol pH fin = 10,3 + log (0,36 / 0,312) =10,36.
avancement maximal : 0,412 -xmax =0 d'où xmax =0,412 mmol [HO-]= 5,88 10-4 / 0,2 = 2,94 10-3 mol/L la soude base la plus forte impose le pH pH= 14 + log 2,94 10-3 = 11,47.
retour - menu |