|
Les ions chlorure sont dosés par
précipitation avec les ions argent Ag+. La
réaction de précipitation
Ag+aq + Cl-aq =
AgCl(s) peut être considérée comme
totale. Le chlorure d'argent formé est un solide
blanc. L'équivalence du dosage sera
déterminée de deux manières :- en
utilisant un indicateur coloré ; - en mesurant la
conductivité lors du dosage.
Dosage colorimétrique
:
L'indicateur coloré de fin de réaction est
préparé en dissolvant quelques grains de
dichlorofluorescéine dans un mélange
eau-éthanol ( méthode de Fajans). La solution
obtenue a une couleur jaune. La présence d'ion sodium
Na+aq et d'ion nitrate
NO3-aq ne modifie pas la
couleur de la dichlorofluorescéine. En revanche, en
présence d'ion argent Ag+aq, la
solution de dichlorofluorescéine prend une couleur
rose rouge.
- Illustration du
fonctionnement de l'indicateur
coloré :
On prépare deux tubes à essai,
numérotés 1 et 2. Dans chaque tube, on
mélange 2,0 mL de solution de chlorure de sodium (
Na+aq +
Cl-aq) de concentration 0,10 mol/L
et quelques gouttes de solution de l'indicateur
coloré préparé avec la
dichlorofluorescéine.
- Dans le tube 1 on ajoute 0,5 mL de solution de nitrate
d'argent
(Ag+aq+NO3-aq)
de concentration 0,10 mol/L.
- Dans le tube 2 on ajoute 2,2 mL de solution de nitrate
d'argent
(Ag+aq+NO3-aq)
de concentration 0,10 mol/L.
Quel est le réactif en excès dans chacun
des tubes ? Justifier.
Quel est l'aspect de la coloration du contenu de chaque
tube ?
réponse :
Quantité de matière initiale d'ion chlorure
dans chaque tube : n(Cl-aq) =
2,0*0,10 = 0,2 mmol.
Quantité de matière initiale d'ion argent
dans le tube 1:
n(Ag+aq)1=0,5*0,10 =
0,05 mmol
Ag+aq+
Cl-aq = AgCl solide.
0,05 mmol d'ion argent réagit avec 0,05 mmol d'ion
chlorure : il reste 0,15 mmol d'ion chlorure ; l'ion
argent est en défaut dans le tube 1 : la solution
est jaune.
Quantité de matière initiale d'ion
argent dans le tube 2:
n(Ag+aq)1=2,2*0,10 =
0,22 mmol
0,2 mmol d'ion argent réagit avec 0,2 mmol d'ion
chlorure : il reste 0,02 mmol d'ion argent ; l'ion argent
est en excès dans le tube 2 : la solution est rose
rouge.
- Principe du
titrage : on veut doser un volume
V1 d'une solution S1 d'ion chlorure
par une solution S2 de nitrate d'argent de
concentration C2. Définir
l'équivalence et expliquer brièvement
comment la déterminer.
réponse :
A l'équivalence les quantités de
matière des réactifs mis en présence
sont en proportions stoechiométriques.
Avant l'équivalence, le réactif titrant,
l'ion argent est en défaut : la solution dans
l'erlenmeyer est donc jaune.
Après l'équivalence, l'ion argent est en
excès : la solution dans l'erlenmeyer est donc
rose rouge.
L'équivalence est repérée par le
changement de teinte.
- Préparation de la
solution à doser : on a
prélever un échantillon d'eau dans un
marais salant. On dilue 10 fois cette eau pour obtenir la
solution S1 à doser. On souhaite
obtenir 50,0 mL de solution S1.
Déterminer le volume d'eau de mer à
prélever.
réponse :
Facteur de dilution = 10 = volume de la solution
diluée / volume de la prise d'eau de mer.
Volume d'eau de mer à prélever : 50,0 / 10
= 5,0 mL.
- Exploitation du
dosage : on réalise le dosage d'un
volume V1 = 10 ,0 mL de solution S1
par une solution S2 de nitrate d'argent de
concentration c2 = 1,00 10-1 mol/L.
Le volume de nitrate d'argent versé à
l'équivalence est VE= 15,2 mL.
Déterminer la concentration molaire des ions
chlorure dans la solution S1, puis dans l'eau
de mer. Masse atomique molaire du chlore : 35,5 g/mol.
réponse :
Quantité de matière d'ion argent à
l'équivalence : VE c2 =15,2
*1,00 10-1 = 1,52 mmol.
Quantité de matière d'ion chlorure :
V1 [Cl-aq] =
10,0[Cl-aq] mmol
D'après les coefficients stoechiométriques de
la réaction Ag+aq+
Cl-aq = AgCl solide :
1,52 = 10,0[Cl-aq] ;
[Cl-aq]
= 0,152 mol/L.
Soit 10*0,152 = 1,52
mol/L dans l'eau du marais salant ( 35,5*1,52 =
54,0 g/L).
Dosage
conductimétrique
:
Conductivité molaire ionique
à 25°C en S m2 mol-1 :
lCl-
= 7,63 10-3 ; lAg+
= 6,19 10-3 ; lNa+
= 5,01 10-3 ; lNO3-
= 7,14 10-3 ;
On donne l'évolution de la conductivité au
cours du dosage en fonction du volume de nitrate d'argent
versé :
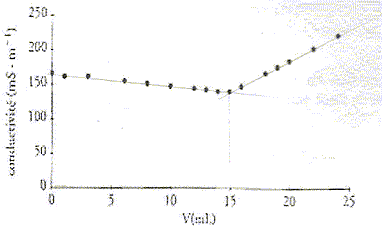
- Déterminer graphiquement sur la courbe le
point d'équivalence E du dosage.
- Justifier, sans calculs, la diminution de la
conductivité avant l'équivalence.
- Justifier, sans calculs, l'augmentation de la
conductivité après
l'équivalence.
réponse :
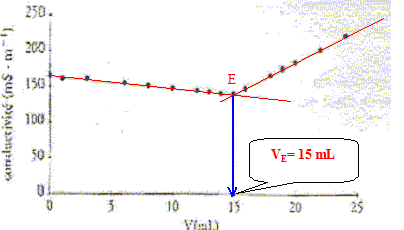
Avant l'équivalence
l'ion argent est en défaut ; une certaine
quantité de matière d'ion chlorure
disparaît (Ag+aq+
Cl-aq = AgCl solide
) pour être remplacée par
la même quantité de matière d'ion
nitrate. Or lCl-
= 7,63 10-3 et lNO3-
= 7,14 10-3 : lNO3-
<lCl-
. De plus le volume de la solution augmente : les
concentrations des ions diminuent.
En conséquence la
conductivité de la solution diminue.
Après l'équivalence
l'ion argent est en excès ; on ajoute des ions argent
et des ions nitrate : en conséquence la
conductivité de la solution augmente.
Questions à choix
multiples
:
- La salinité de l'eau de
mer caractérise la quantité :
a. d'ions présents
dans l'eau
b. de particules présentes
c. d'ions carbonates dissous.
- Le pH de l'eau de mer est
compris entre
a. 2 et 5
b. 5 et 7
c. 7 et
9. ( du fait de la
présence des ions carbonates
CO32-)
|

