|
Propriétés d'une solution d'ammoniac bac S Inde 2008. |
||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
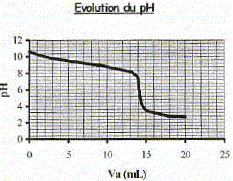
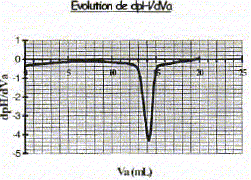
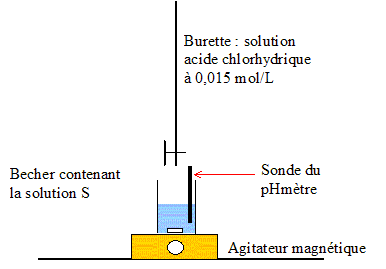
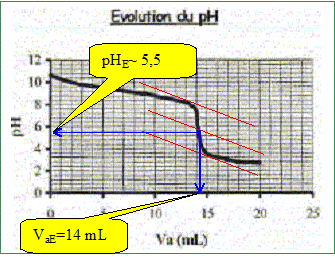
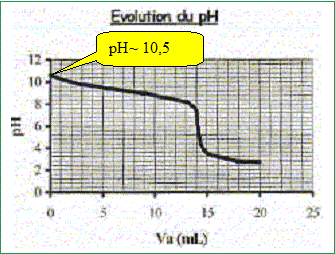
Produit ionique de l'eau : Ke = 1,0.10-14. pKa des couples acide/base : H3O+(aq) / H2O( l) : pKa1 = 0 NH4+(aq) / NH3(aq) : pKa2 = 9,2 ; H2O(l ) / HO-(aq) : pKa3 = 14 Une solution commerciale S0 d'ammoniac NH3(aq) de concentration C0 = 1,1 mol.L-1 peut être utilisée, après dilution, comme produit nettoyant (éviers, lavabos, …) ou comme produit détachant (moquette, tapis, …). On se propose d'étudier la solution S d'ammoniac de concentration CS : S est 100 fois plus diluée que S0. Faire la liste de la verrerie nécessaire pour préparer précisément un volume V = 1,00 L de S à partir de S0. Le facteur de dilution étant de 100 et le volume de la fiole jaugée de 1,00 L, il faut utiliser une pipette jaugée de 1000 / 100 = 10,0 mL. Pisette d'eau distillée, pipeteur et bécher. Titrage de la solution diluée S : On se propose de vérifier la valeur de la concentration C0 de S0. Pour cela, la solution S est titrée par une solution d'acide chlorhydrique de concentration Ca = 0,015 mol.L-1. Dans un volume VS = 20 mL de la solution S, on verse progressivement la solution d'acide chlorhydrique et on mesure après chaque ajout le pH du mélange. On peut alors tracer la courbe d'évolution du pH en fonction du volume de solution acide ajoutée Va à l'aide d'un logiciel approprié. On trace aussi la courbe d'évolution de la dérivée dpH/dVa en fonction de Va.
Etude de l'équilibre dans la solution diluée S : On considère maintenant un volume US = 1,0 L de la solution S. Réaction acido-basique dans S : l'équation bilan, notée (2) de la réaction entre l'ammoniac et l'eau est : NH3(aq) + H2O(l ) = NH4+(aq) + HO-(aq) (2) Donner l'expression littérale de la constante d'équilibre K associée à l'équation de la réaction (2). K = [NH4+(aq)][ HO-(aq)] /[NH3(aq)] Exprimer K en fonction de Ke et Ka2. Calculer K. Or NH4+(aq) +H2O(l )= NH3(aq) + H3O+(aq) ; Ka2=[NH3(aq)][H3O+(aq)] / [NH4+(aq)] soit [NH4+(aq)] /[NH3(aq)] = [H3O+(aq)] / Ka2 . Repport dans l'expression de K : K =[ HO-(aq)] [H3O+(aq)] / Ka2 = Ke/Ka2 =10-14/10-9,2 = 10-4,8 = 1,6 10-5. Compléter le tableau d'avancement, ci-dessous, associé à la transformation modélisée par la réaction d'équation (2). Le volume étant US= 1L on peut confondre concentrations et quantités de matière.
[NH4+(aq)] =[ HO-(aq)] = xéq/US ; [NH3(aq)] = (CSUS-xéq)/US~CS Repport dans K = [NH4+(aq)][ HO-(aq)] /[NH3(aq)] = xéq2 / (CSUS2). En déduire la valeur xéq. L'hypothèse est-elle justifiée ? xéq =[KCS]½ US =[1,6 10-5 *0,011]½ = 4,2 10-4 mol. 4,2 10-4 est très inférieur à 0,011 : l'hypothèse est donc justifiée.
Etude conductimétrique : La valeur de la conductivité de la solution diluée S est s = 8,52.10-3 S.m-1. Valeurs des conductivités molaires ioniques (en S.m2.mol-1) : lHO- = 199.10-4 ; l NH4 + = 73,4.10-4. En déduire la valeur commune de la concentration (en mol.L-1) des ions NH4+(aq) et HO-(aq) dans la solution S. s = lHO-[ HO-(aq)] +l NH4 + [NH4+(aq)] = (lHO-+l NH4 +)[ HO-(aq)] [ HO-(aq)] = s / (lHO-+l NH4 +) = 8,52.10-3 /( 199.10-4 +73,4.10-4) [ HO-(aq)] =8,52 / (19,9+7,34) =0,313 mol m-3 = 3,13 10-4 mol/L. Déterminer alors la valeur du pH de la solution S. Ce résultat est-il en accord avec les données expérimentales ? [H3O+(aq)] = Ke / [ HO-(aq)] = 10-14 / 3,13 10-4 =3,19 10-11 mol/L pH= -log [H3O+(aq)] = -log 3,19 10-12 = 10,5, en accord avec la valeur expérimentale.
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|