|
Le Thallium, capture électronique, électrons Auger, propagation des rayonnements dans la matière d'après IMRT En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||
| .
. |
||||||||||||||||||
|
||||||||||||||||||
|
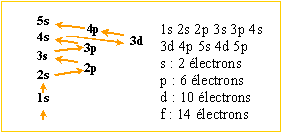
Le thallium 201 20181Tl est utilisé commee traceur de perfusion et de viabilité du muscle. Son mécanisme de fixation repose sur sa ressemblance chimique avec le potassium. Le thallium 201 se désintègre en mercure 201 par capture électronique ; sa période ( demi-vie) vaut T= 73 heures. Masse atomique de Tl 201 : 200,970 819 u ; masse atomique de Hg 201 : 200,970 032 u. Le thallium se trouve, dans la classification périodique, à la sixième ligne et à la treizième colonne. Donner la composition de son nuage électronique. Ordre de remplissage des couches électroniques : Klechlowsky: n + l croissant si n + l égaux dans l'ordre croissant des valeurs de n Les électrons se répartissent dans les orbitales dans l'ordre suivant : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d10 5s2 5p6 4f14 6s2 5d10 6p1. Donner la composition des noyaux du thallium 201, du thallium 203, du thallium 206 . Même nombre de protons : 81 ; des nombres de neutrons différents : 201Tl : 201-81 = 120 neutrons ; 203Tl : 203-81 = 122 neutrons ; 206Tl : 206-81 = 125 neutrons ; Le thallium 204 est radioactif alors que le thallium 203 et le thallium 205 ne le sont pas. Proposer une explication. Les noyaux les plus stables comptent un nombre pair de neutrons : 203Tl : 203-81 = 122 neutrons ; 205Tl : 205-81 = 124 neutrons. 204Tl : 204-81 = 123 neutrons. Quels types de
particules ces deux nucléides peuvent-ils
émettre ? 20081Tl
-->20082Pb +
0-1e ; béta - 20081Tl
-->20080Hg +
01e ; béta + Les noyaux fils peuvent être dans des
états excités et emettre des photons
gamma lors du retour à l'état
fondamental. Formation du thallium 201. Le thallium 203 est soumis à un flux de protons ; il se transmute alors en plomb 201. Donner l'équation de cette transmutation ; préciser le nom des particules émises. 20381Tl + 11p -->20182Pb + 310n ( neutron) Le plomb 201 se transforme spontanément en thallium 201. Donner le nom et l'équation de cette transformation. 20182Pb -->20181Tl + 01e + 00neutrino ( béta + )
Le thallium 201 se transforme en mercure 201 par capture électronique ; sa période ( demi-vie) vaut T= 73 heures. Les émissions principales sont : gamma à 135 keV et 167 keV ; X à 69 keV, 71 keV et 80 keV. Expliquer ce qu'est une capture électronique. Un noyau atomique capture un électron situé sur une couche électronique interne de l'atome. Un proton se transforme alors en neutron : 11p + 0-1 e = 10n + neutrino. Exprimer puis calculer l'énergie disponible de cette transformation. Variation de masse : Dm = m(201 Hg) - m(201Tl) ; énergie libérée : Dm c2= [m(201 Hg) - m(201Tl)]c2 Masse atomique de 201Tl : 200,970 819 u ; masse atomique de 201 Hg : 200,970 032 u. |Dm| =|200,970 032 -200,970 819| = 7,87 10-4 u = 7,87 10-4 *931,5 meV/c2 = 0,733 MeV/c2 = 733 keV/c2. On donne les premiers niveaux excités du noyau de mercure 201 ( 384 keV ; 167 keV ; 32,1 keV). Expliquer la formation des deux émissions gamma. gamma à 135 keV : transition du niveau d'énergie 167 keV au niveau d'énergie 32,1 keV. gamma à 167 keV : transition du niveau d'énergie 167 keV au niveau d'énergie 0 keV.
Quelques valeurs des niveaux d'énergies internes de l'atomes de mercure sont données ci-dessous :
raie ka2 : 83,1-14,2 ~69 keV ; un électron du niveau LII(2p) passe au niveau K(1s) où une place a été libéré par l'arrachement d'un électron. Il en résulte l'émission d'un photon X d'énergie 69 keV. raie ka3 : 83,1-12,3 ~71 keV ; un électron du niveau LIII(2p) passe au niveau K(1s) où une place a été libéré par l'arrachement d'un électron. Il en résulte l'émission d'un photon X d'énergie 71 keV. raie kb1 : 83,1-3,6 ~80 keV ; un électron du niveau MI(3s) passe au niveau K(1s) où une place a été libéré par l'arrachement d'un électron. Il en résulte
l'émission d'un photon X d'énergie 80 keV.
Comment la présence de ce type d'électrons accompagne la formation des rayons X ; donner la signification du groupement de lettre KLL. Les électrons Auger sont des électrons émis lors de la désexcitation d'un atome. Lorsqu'un atome est bombardé par des rayons X ou des électrons de forte énergie, un électron est retiré d’une couche interne d’un atome, laissant une place vacante ; un électron d’une couche de plus haute énergie peut venir remplir cette place : il en résulte un dégagement d’énergie. Cette énergie peut : - Causer l’émission d’un photon X : fluorescence X - Etre absorbée par un électron qui sera éjecté de l’atome (électron Auger) Une transition Auger KLL signifie une éjection initiale d'un électron K suivie d'une transition d'un électron L vers l 'orbitale K. L'énergie cinétique des électrons Auger KLL vaut environ 55 keV. Interpréter. Une transition L--> K libère environ 83-13 = 70 keV. Un autre électron d'un niveau L peut absorbé cette énergie : 14 keV sont utilisés pour arraché l'électron de l'atome ; le reste 70-14 ~ 55 keV est emporté par cet électron Auger sous forme d'énergie cinétique.
Activité d'un échantillon radioactif de thallium 201. Le thallium est livré en ampoule de 10 mL de solution de chlorure de thallium d'activité volumique 125 MBq / mL à la date de fabrication. Les ampoules ont été calibrées pour le lundi 8 h 00. La solution calibrée d'une ampoule est immédiatemment diluée d'un facteur 10 ( 10 mL de l'ampoule dans un volume total de 100 mL) à la livraison. Calculer l'activité volumique de la solution diluée. 125/10 = 12,5 MBq / mL. Calculer la constante radioactive l du thallium. l T = ln2 avec T = 73 heures. l = ln2 / 73 = 9,5 10-3 h-1. On injecte, sous forme d'une solution de chlorure de thallium une dose de 50 MBq à un adulte le jeudi à 8 h00. Calculer l'activité volumique de la solution diluée au moment de l'injection. lundi 8h00 au jeudi 8h00 = 3 jours = 3*24 = 72 heures, soit environ une période L'activité est divisée par deux au bout d'une période soit 12,5 /2 = 6,25 MBq / mL. En déduire le volume de solution à injecter au patient. 50/6,25 = 8 mL.
|
||||||||||||||||||
|
|
||||||||||||||||||
|
|