Ecrire la configuration
électroniques des éléments
suivants :
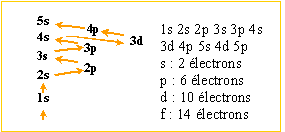
Ordre de remplissage des couches
électroniques :
Klechlowsky: n + l
croissant
si n + l égaux dans l'ordre croissant des valeurs
de n
|
élément
|
structure électronique
|
élément
|
structure électronique
|
|
3Li
|
1s2 2s1
|
24Cr
|
1s2 2s2 2p6
3s2 3p6 4s2
3d4
|
|
5B
|
1s2 2s2
2p1
|
30Zn
|
1s2 2s2 2p6
3s2 3p6 4s2
3d10
|
|
12Mg
|
1s2 2s2 2p6
3s2
|
47Ag
|
ordre prévu :1s2
2s2 2p6 3s2
3p6 4s2 3d10
4p6 4d9 5s2
en réalité : 1s2
2s2 2p6 3s2
3p6 4s2 3d10
4p6
4d10
5s1
l'orbitale 4 d saturée stabilise
l'atome
|
|
17Cl
|
1s2 2s2 2p6
3s2 3p5
|
57La
|
1s2 2s2
2p6 3s2 3p6
4s2 3d10 4p6
4d10 5s2 5p6
4f1 6s2
|
|
15P
|
1s2 2s2 2p6
3s2 3p3
|
79Au
|
1s2 2s2
2p6 3s2 3p6
4s2 3d10 4p6
4d10 5s2 5p6
4f14 6s2
5d9
|
|
35Br
|
1s2 2s2 2p6
3s2 3p6 4s2
3d10 4p5
|
26Fe
|
1s2 2s2 2p6
3s2 3p6 4s2
3d6
|
|
18Ar
|
1s2 2s2 2p6
3s2 3p6
|
29Cu
|
1s2 2s2 2p6
3s2 3p6 4s2
3d9
|
|
19K
|
1s2 2s2 2p6
3s2 3p6
4s1
|
13Al
|
1s2 2s2 2p6
3s2 3p1
|
|
Indiquer dans chaque
cas : la période, le groupe, le sous-groupe,
le bloc ainsi que les propriétés
magnétiques.
Le paramagnétisme résulte de la
présence dans les atomes d'électron
célibataire.
|
|
élément
|
période
|
groupe
|
sous-groupe
|
bloc
|
propriété
magnétique
|
|
3Li
|
2
|
1 ( I A)
|
A
|
s
|
paramagnétique
|
|
5B
|
2
|
13 (III B)
|
B
|
p
|
paramagnétique
|
|
12Mg
|
3
|
2 (II A)
|
A
|
s
|
|
|
17Cl
|
3
|
17 (VII B)
|
B
|
p
|
paramagnétique
|
|
15P
|
3
|
15 ( V B)
|
B
|
p
|
paramagnétique
|
|
35Br
|
4
|
17 (VII B)
|
B
|
p
|
paramagnétique
|
|
18Ar
|
3
|
18 ( VIII B)
|
B
|
p
|
|
|
19K
|
4
|
1 ( I A)
|
A
|
s
|
paramagnétique
|
|
élément
|
période
|
groupe
|
sous-groupe
|
bloc
|
propriété
magnétique
|
|
24Cr
|
4
|
6 ( VI A)
|
A
|
d
|
paramagnétique
|
|
30Zn
|
4
|
12( II B)
|
B
|
d
|
|
|
47Ag
|
5
|
11 ( I B)
|
B
|
d
|
paramagnétique
|
|
57La
|
6
|
3 (III A)
|
A
|
f
|
paramagnétique
|
|
79Au
|
6
|
11 ( I B)
|
B
|
d
|
paramagnétique
|
|
26Fe
|
4
|
8(VIII )
|
|
d
|
ferromagnétique
|
|
29Cu
|
4
|
11 ( I B)
|
B
|
d
|
paramagnétique
|
|
13Al
|
3
|
13 (III B)
|
A
|
p
|
paramagnétique
|
Parmi ces éléments
, citer les : métaux, métaux de transition,
non-métaux, halogènes et gaz
rares ?
|
|
élément
|
métal, non métal,
transition ....
|
|
3Li
|
métal
|
|
5B
|
non métal
|
|
12Mg
|
métal
|
|
17Cl
|
non métal,
halogène
|
|
15P
|
non métal
|
|
35Br
|
non métal,
halogène
|
|
18Ar
|
gaz rare
|
|
19K
|
métal
|
|
24Cr
|
métal de
transition
|
|
30Zn
|
métal de
transition
|
|
47Ag
|
métal de
transition
|
|
57La
|
métal de transition ,
lanthanide
|
|
79Au
|
métal de
transition
|
|
26Fe
|
métal de
transition
|
|
29Cu
|
métal de
transition
|
|
13Al
|
métal
|
|
Un élément X
appartient au mêmes groupe que le carbone
6C et la même période que le
lanthane 57La.
Donner sa configuration
électronique, préciser alors les quatre nombre
quantiques caractérisant l’électron
célibataire du
lanthane.
Le lanthane appartient à la 6è
période ; le carbone appartient au sous-groupe IV A :
donc Pb.
Configuration électronique du plomb :
1s2 2s2 2p6 3s2
3p6 4s2 3d10 4p6
4d10 5s2 5p6 4f14
6s2 5d10 6p2
Electron célibataire du lanthane : n = 6 ;
l = 3 ; valeurs possibles pour m : -3 ; -2 ; -1 ; 0 ; 1 ; 2
; 3 ; spin de l'électron +½ ou -½.
