|
Chimie lycée : magnésium et acide chlorhydrique, acide oxalique, En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
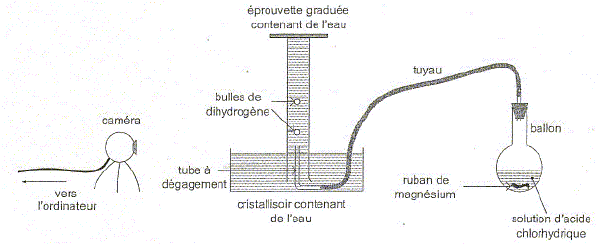
Elodie :" nous devrions étudier un mouvement ascendant et un mouvement descendant". Arthur :" j'ai une idée. Pour étudier le mouvement ascendant nous pourrions filmer le mouvement dans l'eau de bulles de gaz ". Charlotte :" Et si par exemple nous filmions le mouvement ascendant de bulles d'hydrogène produites par réaction de l'acide chlorhydrique avec le magnésium ?" Arthur : " Et ensuite, pour comparer, nous pourrions filmer le mouvement d'une bille métallique lâchée dans l'air ". A l'aide d'une caméra reliée à un ordinateur, les élèves filment la transformation chimique entre l'acide chlorhydrique et le magnésium produisant du dihydrogène. Le schéma de l'expérience est reproduit ci-dessous :
Etude de la transformation chimique. A l'instant t=0 s, le ruban de magnésium est mis en contact avec la solution d'acide chlorhydrique. Solution d'acide chlorhydrique : c =0,50 mol/L ; V= 40 mL. Magnésium : m = 0,12 g ; Masse molaire M= 24 g/mol. Volume molaire des gaz dans les conditions de l'expérience : Vm= 24 L/mol. L'équation de la réaction associée à la transformation chimique qui a lieu dans le ballon s'écrit : Mg(s) + 2H+(aq) = Mg2+(aq) + H2(g). Identifier les couples oxydant / réducteur mis en jeu dans cette réaction. Mg2+(aq) / Mg(s). H+(aq) / H2(g).
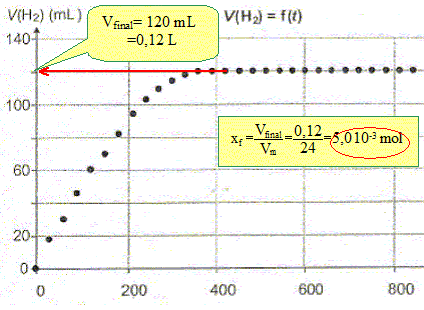
A partir des quantités de matière initiales montrer que l'avancement maximal est xmax = 5,0 10-3 mol .
si H+ est en défaut : 2,0
10-2-2xmax =0 soit
xmax =1,0 102 mol On retient la plus petite valeur :
xmax =5,0
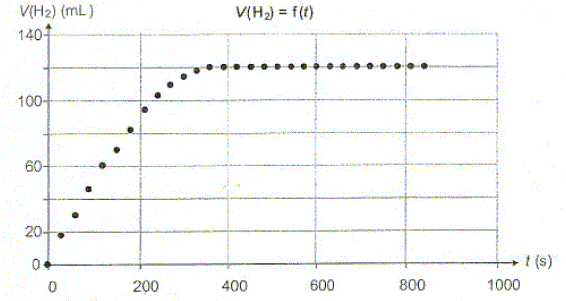
10-3 mol. La figure ci-dessous représente la
variation de la valeur du volume de
dihydrogène dégagé au cours du
temps.
La transformation est-elle totale ? Justifier. Le taux d'avancement final t vaut : t = xf/xmax = 1 en conséquence la transformation est totale.
acide oxalique et ion permanganate ( 3 points )
On désire connaître la concentration molaire c0 d'une solution de permanganate de potassium. L'ion permanganate est l'oxydant du couple MnO4-/Mn2+. On prépare pour cela une solution incolore d'acide oxalique en dissolvant 5,0 g du solide cristallisé C2H2O4,2H2O dans 100 mL d'eau distillée. On titre ensuite 10 mL de la solution de permanganate de potassium par la solution d'acide oxalique acidifiée.
corrigé 5 fois {C2H2O4 = 2 CO2+ 2e- + 2H+} 2 fois { MnO4-+ 5e- + 8H+ = Mn2+ + 4 H2O} 5C2H2O4 + 2MnO4-+6H+ =10 CO2+ 2Mn2+ + 8 H2O M[C2H2O4,2H2O]= 2*12+2+4*16+2*18=126 g/mol Qté de matière (mol) = masse (g) / masse molaire (g/mol) = 5/126 =3,97 10-2 mol concentration c1 (mol/L= Qté de matière (mol) / volume de la solution (L) =3,97 10-2/0,1 =0,397 mol/L. l'ion permanganate, la seule
espèce colorée, sert d'oxydant et d'indicateur
de fin de réaction : avant l'équivalence
MnO4- est en excès (couleur
violette); après l'équivalence
MnO4- est en défaut ( solution
incolore) 0,397*12 10-3 = 4,76 10-3
mol 10-2C0 -2xéqui=0 ;C0 = 200xéqui=200*9,53 10-4 =0,19 mol/L.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|