|
Pile à combustible alcaline En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
| .
. |
||||||
|
||||||
|
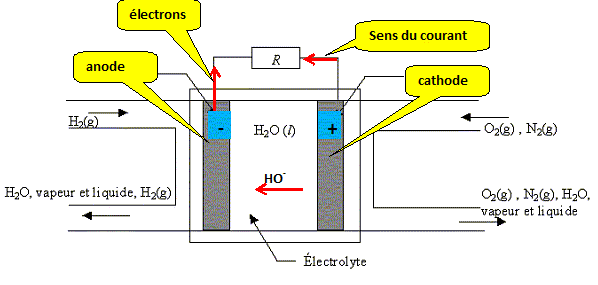
Dessiner la pile Pt H2 (1bar) H2O ,KOH(1mol.L ) O2(g)(1bar) Pt Préciser sur ce schéma sa polarité et le sens de déplacement des électrons.
L'oxydation libère des électrons ;
l'anode constitue la borne négative de la
pile. Un oxydant qui se réduit gagne des électrons ; la cathode constitue la borne positive de la pile. Les électrons se déplacent dans les électrodes en platine et dans de dipole récepteur Dans la potasse les anions hydroxyde HO- se déplace dans le sens contraire du courant, c'est à dire dans le même sens que les électrons.
Etude de la pile : Ecrire les deux demi réactions ayant lieu aux deux électrodes dans le milieu électrolytique contenant la potasse. Oxydation à l'anode du dihydrogène H2(g). 2H2(g) + 4HO-(aq) = 4H2O(l) + 4e- (1). Réduction à la cathode du dioxygène O2(g). O2(g) + 4e-+ 2H2O(l) = 4HO-(aq) (2). Bilan : 2H2(g) + O2(g) = 2H2O(l).
Bilan : 2H2(g) + O2(g) = 2H2O(l). Quantité de matière de dioxygène : nO2 = ½ n H2 = 75,7 mol Masse molaire du dioxygène M = 32 g/mol masse de dioxygène : m = nO2 M = 75,7*32 =2,42 103 g en une heure.
|
||||||
|
|
||||||
|
|