|
Oxydation de SiCl4 : dosage indirect, cinétique concours général 2006 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
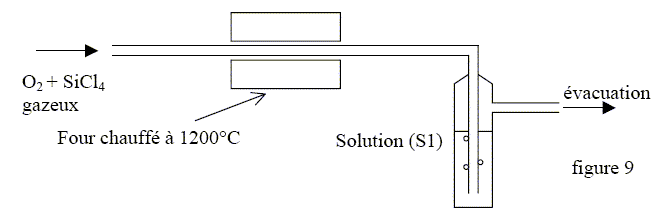
Equation de formation de la silice. SiCl4(g) + O2(g) = SiO2(s) + 2Cl2(g). Pour suivre la cinétique de cette réaction, on dose le dichlore formé par le protocole suivant : Les réactifs gazeux passent à débit constant dans un four à 1200 °C dans lequel se produit la réaction. Le mélange gazeux en sortie contenant les réactifs qui n'ont pas réagi et les produits barbotent dans V1 = 100 mL d'une solution aqueuse, notée S1, contenant K+(aq) et I-(aq) à la concentration de 1 mol/L et 2Na+(aq) + S2O32-(aq) à la concentration c1 = 8,00 10-3 mol/L.
Solution K+(aq) et I-(aq) : iodure de potasium Solution 2Na+(aq) + S2O32-(aq) : thiosulfate de sodium Cl2(g) + 2e- = 2
Cl-(aq) réduction 2 S2O32-(aq)
=S4O62-(aq) +
2e- oxydation Cl2(g) + 2
S2O32-(aq)
=S4O62-(aq) + 2
Cl-(aq).
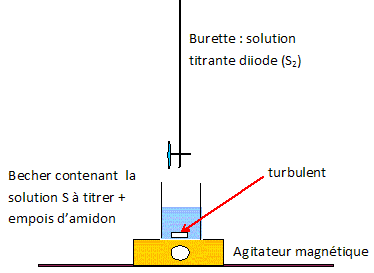
(1) I2(aq) + 2e- = 2 I-(aq) réduction 2 S2O32-(aq) =S4O62-(aq) + 2e- oxydation I2(aq) + 2 S2O32-(aq) =S4O62-(aq) + 2 I-(aq). (2) L'empois d'amidon joue le rôle d'indicateur coloré de fin de réaction.
Le volume de solution S2 ajouté à l'équivalence est VE = 19,3 mL.
Quantité de matière S2O32-(aq) ayant réagi avec le dichlore. Quantité de matière initiale de S2O32-(aq) : V1c1 = 0,1 *8,00 10-3 =8,00 10-4 mol I2(aq) + 2 S2O32-(aq) =S4O62-(aq) + 2 I-(aq). (2) Quantité de matière à l'équivalence de I2(aq) : n(I2) =VEc2 = 0,0193 *5,00 10-3 =9,65 10-5 mol n(S2O32-(aq)) excès = 2 n(I2) = 2*9,65 10-5 =1,93 10-4 mol puis : 8,00 10-4 - 1,93 10-4 =6,07 10-4 mol. Le gaz a barboté dans la solution S1 pendant un temps t = 10 min. Débit molaire Dm (mol s-1) du dichlore à la sortie du four. Cl2(g) + 2 S2O32-(aq) =S4O62-(aq) + 2 Cl-(aq). (1) n(Cl2(g)) = 0,5 n(S2O32-(aq)) = 6,07 10-4 / 2 = 3,035 10-4 mol durée : 60*10 = 600 s. Dm = 3,035 10-4 / 600 = 5,06 10-7 mol s-1. Le débit volumique DV du gaz vaut 2,3 mL s-1 = 2,3 10-3 L s-1. Concentration du dichlore [Cl2] à la sortie du four. [Cl2] = Dm /DV = 5,06 10-7 / 2,3 10-3 =2,2 10-4 mol/L. La concentration de SiCl4 à l'entrée du four vaut [SiCl4]0 =3,3 10-4 mol/L. Concentration de SiCl4 à la sortie du four. SiCl4(g) + O2(g) = SiO2(s) + 2Cl2(g) Quantité de matière SiCl4 ayant réagi : n(SiCl4) = 0,5 n(Cl2(g)) 2,2 10-4 /2 =1,1 10-4 mol/L. [SiCl4]sortie =3,3 10-4 -1,1 10-4 ; [SiCl4]sortie =2,2 10-4 mol/L.
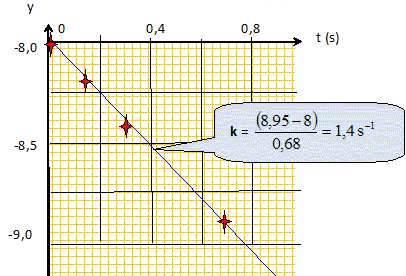
La vitesse moyenne des gaz dans le tube est de l'ordre de 10 cm s-1 ; la flamme du chalumeau ( où se produit la réaction) fait environ 3 cm de large. Calcul du pourcentage de SiCl4 oxydé. Durée de la réaction : t = 3/10 = 0,3 s. ln[SiCl4] -ln[SiCl4]0 = -kt = -20*0,3 = -6 ln ([SiCl4] /[SiCl4]0 ) = -6 ; [SiCl4] /[SiCl4]0 = exp(-6) = 2,5 10-3.( 0,25 %) 99,75 % de SiCl4 est oxydé.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|