|
acide base : dosage, dilution, pourcentage massique, T.A.C. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
Quelles précautions faut-il prendre pour préparer la solution S ? Le produit ménager est corrosif,il provoque des brûlures : port de blouse, gants et lunettes. Ecrire l'équation bilan de la réaction de dosage. Couples acide/ base : H2O/HO- (aq) et H3O+ (aq) / H2O. HO- (aq) + H3O+ (aq) = 2H2O. Calculer la constante Kr de cette réaction. Kr = 1 / ([HO-(aq)][H3O+(aq)] ) = 1 / 10-14 = 1014. - En déduire la
valeur du pH à
l'équivalence. - Choisir un indicateur
coloré à ce
dosage. La zône de virage de l'indicateur coloré doit contenir le pH du point équivalent : le bleu de bromothymol convient. Calculer la concentration molaire de la solution S. A l'équivalence les quantités de matière de réactifs mis en présence sont en proportions stoechiomètriques. Vb Cb = CaVE ; Cb =CVaVE / Vb Cb =0,1*17,8 / 20 = 8,9 10-2 mol/L.Calculer la concentration molaire de la solution S0. On prélève 10 mL de la solution S0 que l'on verse dans une fiole jaugée de 1 L ou 1000 mL Le facteur de dilution est F = 1000 / 10 = 100. La solution S0 est donc 100 fois plus concentrée que la solution S. C0 = 0,089*100 = 8,9 mol/L. En déduire le pourcentage massique du produit domestique en soude. Données : M(Na)=23; M(O)=16; M(H)=1 Densité du produit d=1,23. Masse molaire de l'hydroxyde de sodium M = 23+16+1 = 40 g/mol. masse d'hydroxyde de sodium dans 1 L : m = 8,9*40 = 356 g. masse de 1 L de produit : 1,23 kg = 1,230 g pourcentage massique en hydroxyde de sodium : 356/1230 =0,29 ( 29 %).
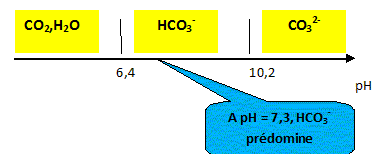
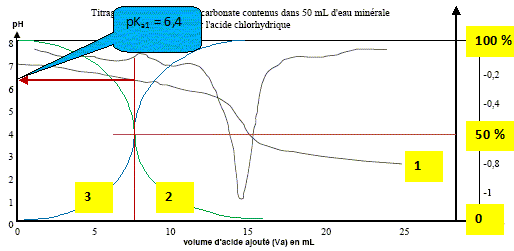
Les ions hydrogénocarbonate dans une eau minérale L'étiquette d'une bouteille d'eau minérale porte les informations suivantes : HÉPAR-Minéralisation caractéristiques en mg/L Calcium: 155 ; Magnésium : 110 ; Sodium : 14 ; Sulfate : 1 479; Hydrogénocarbonate : 430 ; pH non indiqué - Résidu à sec à 180 °C : 2 580 mg/L Données : CO2,H2O / HCO3- : pKa1 = 6,4 ; HCO3- / CO32-: pKa2 = 10,3 Masses molaires : M(C) = 12 g.mol-1 ; M(H) = 1 g.mol-1 ; M(O) = 16 g.mol-1. Zone de virage du vert de bromocrésol : jaune 3,8 < pH < 5,4 bleu ; du violet de bromocrésol : jaune 5,2 < pH < 6,8 violet du bleu de bromothymol : jaune 6,0 < pH < 7,6 bleu Le pH de l'eau minérale. Sur un axe gradué en pH, placer les domaines de prédominance des espèces acide et basique des deux couples de l'ion hydrogénocarbonate. Le pH de l'eau minérale est 7,3. Quelle est l'espèce majoritaire ? Justifier.
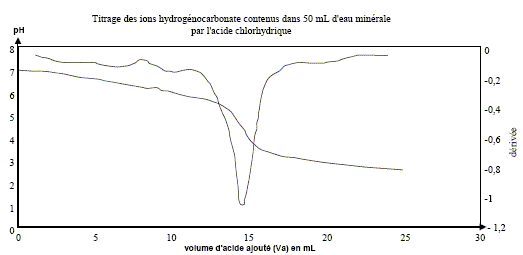
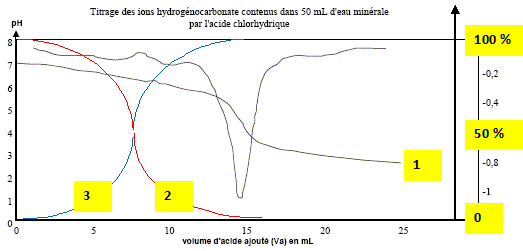
à pH > pKa1, HCO3- la base du couple CO2,H2O / HCO3- prédomine ; à pH < pKa2, HCO3- l'acide du couple HCO3- / CO32-: prédomine. Dosage pH-métrique de l'eau minérale. Un volume V1 = 20,0 mL d'eau minérale est dosé par l'acide chlorhydrique de concentration molaire en soluté apporté C2 égale à 0,010 mol.L-1 . Soit v le volume d'acide ajouté. Sur la figure ci-dessous sont représentés les points expérimentaux ainsi que l'allure de la fonction dérivée .
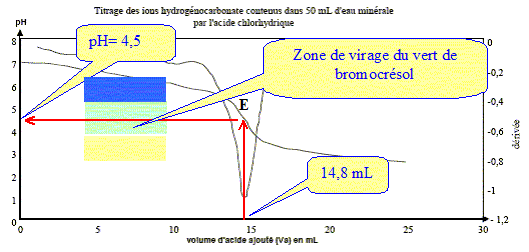
Écrire l'équation chimique de la réaction de dosage des ions hydrogénocarbonate. couples acide/base : H3O+/H2O ( acide chlorhydrique) ; CO2,H2O / HCO3- . HCO3- + H3O+ = CO2 +2 H2O. Parmi les indicateurs colorés du tableau des données, quel est celui qui est le plus approprié au dosage ? Justifier votre choix.
Le choix du vert de bromocrésol comme indicateur coloré est judicieux : le pH du point équivalent appartient à la zone de virage de cet indicateur. Déterminer la concentration en ions hydrogénocarbonate dans l'eau minérale ; la comparer avec celle donnée sur l'étiquette. A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. V1[HCO3- ] = Va E C2 ; [HCO3- ] = Va E C2 / V1 [HCO3- ] =14,8* 1,0 10-2 / 20 = 7,4 10-3 mol/L. Concentration massique T des ions hydrogénocarbonate dans cette eau minérale : masse molaire HCO3- : M= 1+12+3*16 = 61 g/mol. T = [HCO3- ] M = 7,4 10-3 * 61 = 0,45 g/L ( 450 mg) L'étiquette indique 430 mg (
écart relatif 450-430) / 430 ~ 0,05 ( 5 %) donc
accord avec l'indication de l'étiquette.
|
|||||||
|
|
|||||||
|
|