|
réaction d'oxydoréduction et pile cuivre / aluminium, concours manipulateur radio Poitiers 2009.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
|
Couleur des ions en solution : Cu2+aq (bleue) ; Al3+aq et NO3- aq : incolore. Masse molaire ( g/mol) : MAl = 27,0 ; MCu = 63,5. 1 F = 96,5 103 C mol-1. S1 : solution de nitrate de cuivre (II) (Cu2+aq + 2NO3- aq ) de concentration c1 = 0,100 mol/L S2 : solution de nitrate d'aluminium (Al3+aq + 3NO3- aq ) de concentration c2 = 0,100 mol/L. Etude de la réaction d'oxydoréduction. Dans un becher on mélange un volume V1 de solution S1 et un volume V2 de solution S2 avec V1 = V2 = 100,0 mL. Les ions nitrates sont spectateurs. Calculer les concentrations initiales dans le mélange des ions Cu2+aq et Al3+aq. [Cu2+aq]i = c1V1/(V1+V2 )= c1V1/(2V1)=½c1 =5,00 10-2 mol/L. [Al3+aq]i = c2V2/(V1+V2 )= c2V2/(2V2)=½c2 =5,00 10-2 mol/L.
On considère la
réaction dont l'équation notée
(1) figure dans les données. Ecrire l'expression
littérale de son quotient de réaction
Qr. Qr i = [Al3+aq]i2 / [Cu2+aq]i3 = (5,00 10-2)2 / (5,00 10-2)3 = 1/(5,00 10-2)= 20,0. En déduire, en justifiant, que le système évolue spontanément dans le sens direct de l'équation (1). Qr i < K : d'après le critère d'évolution spontané, le système évolue dans le sens direct.
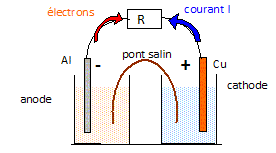
Constitution d'une pile cuivre / aluminium. On dispose : - d'un becher contenant V1 = 100,0 mL de solution S1 - d'un becher contenant V2 = 100,0 mL de solution S1 - d'une lame de cuivre de masse m1=6,35 g et d'une lame d'aluminium de masse m2 = 2,70 g. - d'un pont salin et d'un conducteur ohmique de résistance R. On réalise une pile cuivre /aluminium débitant dans le conducteur ohmique un courant le traversant de la lame de cuivre vers la lame d'aluminium. Faire le schéma annoté de la pile débitant dans le conducteur ohmique en indiquant : le sens du courant, les bornes + et - de la pile, le sens de déplacement des électrons, l'anode, la cathode.
Ecrire les demi-équations aux électrodes en précisant s'il s'agit d'une oxydation ou d'une réduction. En déduire l'équation de la réaction, considérée comme totale, de fonctionnement de la pile. Oxydation de l'aluminium à l'anode : 2Al(s) = 2Al3+aq + 6 e-. Réduction de l'ion cuivre II à la cathode : 3Cu2+aq + 6 e- = 3Cu(s) 2Al(s) + 3Cu2+aq = 3Cu(s) + 2Al3+aq.
|
|||||||||||||||||||||||||||||||||
|
c |
|||||||||||||||||||||||||||||||||
|
|