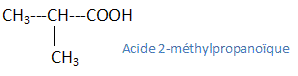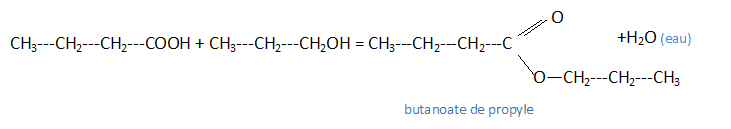|
Autour de l'acide butyrique ( Kiné EFOM 2001)
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
Ecrire la formule générale d'un monoacide carboxylique à chaîne linéaire saturée en faisant apparaître la fonction acide. CnH2nO2 ou Cn-1H2n-1-COOH On fait réagir un de ces acides sur du pentachlorure de phosphore, on obtient ainsi un composé organique B, non ramifié, de masse molaire 106,5 gmol-1. Ecrire l'équation-bilan de la réaction. Cn-1H2n-1-COOH + PCl5 = Cn-1H2n-1-COCl + POCl3 + HCl. Indiquer le groupe fonctionnel du composé B, donner sa formule générale. Chlorure d'acyle R-COCl ou Cn-1H2n-1-COCl Déterminer sa formule développée et vérifier que l'acide A dont il dérive est l'acide butanoïque. Masse molaire RCOCl : M = 12(n-1) + 2n-1 + 12 +16 +35,5 = 106,5 14n+50,5 = 106,5 ; n = 4 Un acide carboxylique à chaîne linéaire saturée comptant 4 atomes de carbone est l'acide butanoïque.
(1) : C est un alcool primaire qui est oxydé en acide carboxylique C --> A (2) : acide carboxylique + alcool donne un ester et de l'eau ( estérification) A + D --> E + H2O (3) : saponification ( hydrolyse basique ) d'un ester. E + NaOH --> F + Na+ + CH3OH On en déduit l'alcool primaire D : le méthanol. (4) F + H3O+ --> A + H2O (5) : passage d'un acide carboxylique au chlorure d'acyle. A + SOCI2 --> B + SO2 + HCl (6) : chlorure d'acyle + amine donne un amide. B + G --> N-méthyl-butanamide + HCl On en déduit que : B est le chlorure de butanoyle CH3-CH2-CH2 COCl et G la méthylamine CH3-NH2. (6) : CH3-CH2-CH2 COCl + 2CH3-NH2 = CH3-CH2-CH2 CO-NH-CH3 + CH3-NH3+ + Cl-. A est l'acide butanoïque : CH3-CH2-CH2 COOH (5) : CH3-CH2-CH2 COOH + SOCI2 --> CH3-CH2-CH2 COCl + SO2 + HCl (1) : CH3-CH2-CH2 CH2OH oxydé en CH3-CH2-CH2 COOH ; C est le butan-1-ol. (2) CH3-CH2-CH2 COOH + CH3OH = CH3-CH2-CH2 COO-CH3 + H2O. E : butanoate de méthyle. (3) CH3-CH2-CH2 COO-CH3 + NaOH --> CH3-CH2-CH2 COO- + Na+ + CH3OH. (4) CH3-CH2-CH2 COO- + H3O+ --> CH3-CH2-CH2 COOH + H2O
- L'acide butyrique est un acide gras de formule : CH3-CH2-CH2-COOH Donner le nom de cet acide en utilisant la nomenclature officielle. Identifier son groupe fonctionnel. acide butanoïque ; groupe fonctionnel -COOH. Quels sont ses isomères acides, donner leur noms et formules semi-développées.
Écrire l'équation-bilan de la réaction entre l'acide butyrique et le propan-1-ol. Nommer les produits de la réaction.
Quelles sont les caractéristiques de cette réaction ? Lente, limitée par l'hydrolyse de l'ester, athermique.
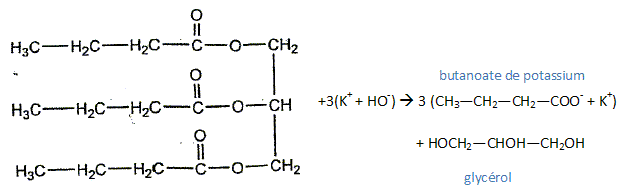
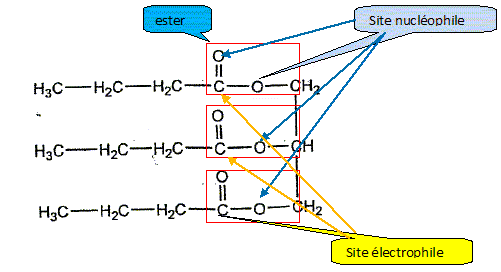
Le rendement de cette réaction est de 65 %. Quelle masse de butyrine faut-il, au maximum, pour obtenir 900 g de savon ? Données: Masses molaires atomiques en g.mol-1 : M(H) = 1,0 ; M(C) = 12,0 ; M(O) = 16,0 ; M(K) = 39 ; 100/65 = 1,54 ; 302/126 = 2,4 ; 1,54 x 2,4 = 3,6. Masse molaire du savon M(C4H7O2K) = 12*4+7*32+39=126 g/mol Quantité de matière de savon : n = m/M = 900/126 =7,14 mol
3xmax =900/126 ; xmax =300/126 d'où n0 = 300/126 mol Masse molaire de la butyrine M( C15H26O6) = 15*12+26+6*16 = 302 g/mol. masse de butyrine : m = n M =300/126*302 = 300*2,4 g Et en tenant compte du rendement : 300*2,40/0,65 =300*2,4*1,54 = 300*3,6 =1,08 103 g = 1,1 kg.
|
|||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||
|
|