|
Fluorure
d'hydrogène ; solution d'acide fluorhydrique, acide
base, réactivité
concours ingénieur
Minefe 2008. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(1) CaF2(s) + H2SO4(l) = CaSO4(s) + 2HF(g). On donne les enthalpies standards de formation DrH° et les entropies molaires standards Sm° à 25 °C :
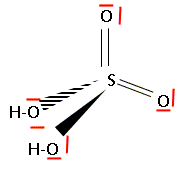
Numéro atomique : H : 1 ; O : 8 ; S : 16. Proposer une représentation de Lewis de l'acide sulfurique.
Définir et calculer la variance d'un système où se produit l'équilibre (1). La règle des phases donne la variance d'un système thermodynamique : v = c+2-j Le chiffre 2 indique le nombre de paramètres intensifs. c : nombre de constituants indépendants ( nombre de constituants - nombre de réactions chimiques indépendantes entre ces constituants) Nombre de constituants : c=4 ; nombre de relation : 1 ; nombre de phase : j= 4 v = c-1+2-j= 4-1+2-4 =1. On peut faire varier la température ou la pression. Calculer l'enthalpie libre standard de cette réaction à 298 K ? Pour une mole de HF formé :(1) ½CaF2(s) + ½ H2SO4(l) = ½ CaSO4(s) + HF(g). DrH° =½DrH°(CaSO4(s)) + DrH°(HF) -½DrH°(H2SO4(l))-½DrH°(CaF2(s)) DrH° = -½*1434,1-271,1 +½ *814 + ½ *1219,6 ; DrH° = 28,65 kJ mol-1. DrS° =½S°(CaSO4(s)) + S°(HF) -½S°(H2SO4(l))-½S°(CaF2(s)) DrS° =½*106,7+173,7-½*156,9-½*68,9 = 114,15 J mol-1 K-1 DrG° =DrH° - TDrS° =28,65 - 298*0,11415 = -5,37 kJ mol-1 pour 1 mole de HF formé. La constante d'équilibre s'écrit :
K = PHF. De plus DrG°
=-RT
ln K ; ln K = -5,37 103/(-8,31*298)
=2,17 K = 8,7 d'où
PHF =
8,7 bar. A t-on
intérêt à pratiquer cette
synthèse à faible pression ou
à haute pression ? Si la pression augmente, le nombre de
molécules de HF croît : en
conséquence l'équilibre est
déplacé vers la gauche, sens
indirect, diminution du nombre de molécules
HF. On a donc intérêt à
travailler à faible pression.
L'ion [F-H-F]- est linéaire ; il possède une liaison hydrogène forte ; l'atome d'hydrogène est à mi-chemein entre les deux atomes de fluor. Exprimer c en fonction de [HF], [F-] et de [F2H-]. Conservation de l'élément fluor : c = [HF] + [F-] + 2[F2H-] Quel serait le pH et la valeur de c, d'une solution d'acide fluorhydrique où l'on trouverait des concentrations égales en ions F- et F2H- ? On négligera l'autoprotolyse de l'eau.
[H+] = [F2H-] +[F-] = 2 [F-]
Donc [F-] =[F2H-]= 0,5*1,68 10-2 = 8,4 10-3 mol/L ; [HF] = 10-0,67 =0,214 ; c = [HF] + [F-] + 2[F2H-] =0,214 + 8,4 10-3 + 2* 8,4 10-3 ; c =0,24 mol/L. En déduire la proportion de fluorure d'hydrogène qui a globalement réagi dans les conditions de la question précédente. 3*8,4 10-3 /0,24 = ~ 0,10 ( 10 %).
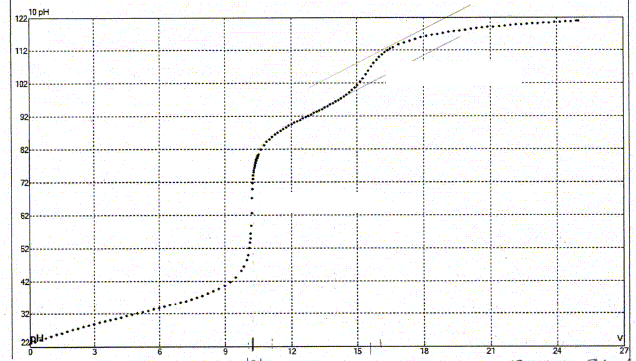
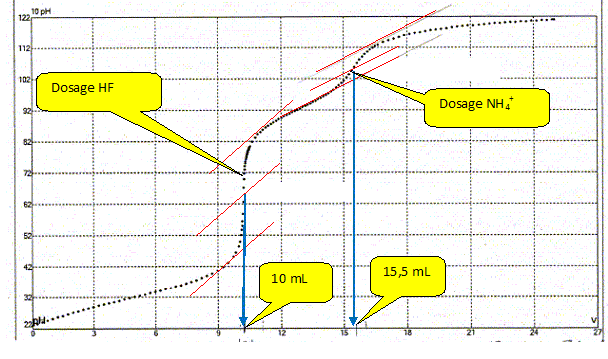
Une prise d'essai de 10,0 mL d'un mélange d'acide fluorhydrique et de chlorure d'ammonium ( pKa (NH4+ / NH3) = 9,2)) est dosé par une solution de soude CNaOH= 45,0 mmol/L. Ce dosage est suivi par pHmétrie. La courbe suivante est obtenue :
En déduire la concentration en acide fluorhydrique et en chlorure d'ammonium.
(4) HF + HO- = F- + H2O ; K =10-3,18 / 10-14 =6,6 1010 (5) NH4+ + HO- = NH3 + H2O ; K = 10-9,2 /10-14 =6,3 104 Premier saut de pH : (4) réaction prépondérante ; à l'équivalence les quantités de matière de soude et d'acide fluorhydrique sont en proportions stoechiométriques. CaVa= CbVb ; Ca= CbVb /Va= 45 10-3*10/10 = 4,5 10-2 mol/L. Second saut de pH : (5) réaction prépondérante ; CaVa= CbVb ; Ca= CbVb /Va= 45 10-3*(15,5-10)/10 = 2,5 10-2 mol/L.
Soit
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
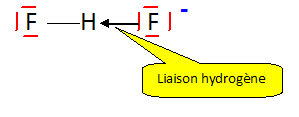 ion
bifluorure
ion
bifluorure