|
Etude du biogaz de décharge, chimie concours Mines 08
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||
|
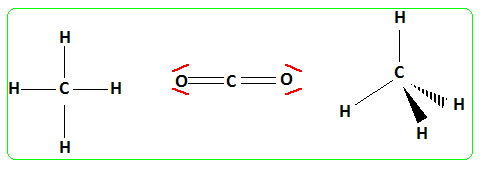
Étude de la réaction de méthanation du glucose. Les glucides étant des molécules basées sur le glucose de formule brute C6H12O6, nous étudierons ici sa décomposition. Écrire l’équation de la transformation de glucose en méthane et dioxyde de carbone. C6H12O6 = 3CH4 + 3CO2. Proposer une représentation de Lewis pour les molécules de méthane et de dioxyde de carbone. Proposer une structure spatiale pour chacune de ces deux molécules (indiquer les valeurs des angles de liaison).
Dans la structure tétraèdrique
régulière du méthane, les anles
mesurent 109,28°. CO2 est linéaire,
les angles mesurent 180°.
Hormis quelques
applications pour lesquelles le biogaz peut
être utilisé directement, il est
généralement purifié.
L’épuration consiste à
éliminer les éléments trace
(H2S, H2O) mais
également le dioxyde de carbone afin
d’enrichir le biogaz en méthane.
L’épuration se fait
généralement à des pressions
de quelques dizaines de bars, nous prendrons ici
une pression P = 10 bar. La composition molaire du
biogaz considéré est : CH4
: 60 %, CO2 : 39 %, H2S :
0,10 % et H2O : 0,90 %
. L’eau liquide peut dissoudre le dioxyde de carbone. Elle est en général éliminée par condensation ou par passage dans un dessicateur. La dissolution du dioxyde de carbone est telle que la concentration en CO2(d) dissous est proportionnelle à la pression partielle en CO2(g) suivant la loi : [CO2(d)] = KCO2 PCO2/P° . c°. (on rappelle que c° = 1,00 mol.L-1 et P° = 1,00 bar). Au cours du trajet du biogaz et compte tenu de variations de température éventuelles, l’eau peut se condenser en gouttelettes. On donne la valeur numérique de la constante à 300 K : KCO2= 2,5.10-2. Pour l’étude qui suit, la pression et la température sont constantes et valent : P = 10 bar et T = 300 K. Exprimer puis calculer la concentration en CO2(d) des gouttelettes d’eau en contact avec le dioxyde de carbone. Afin de simplifier les calculs numériques, vous pourrez arrondir le pourcentage à 40 %. PCO2 = fraction molaire CO2 * pression totale = 0,39 P = 0,39*10 = 3,9 bar ~ 4 bar. [CO2(d)] = KCO2 PCO2/P° . c° = 2,5.10-2*3,9 ~ 0,10 mol/L. En déduire le pH de cette
solution. On
négligera les propriétés acido-basiques
des constituants chimiques autres que le dioxyde de
carbone. 4 10-7(0,10-xéq ) = x2éq ; x2éq +4 10-7xéq -4 10-8=0 ; xéq ~2,0 10-4 mol/L ; pH = -log [H3O+] = - log (2,0 10-4) = 3,7. les gouttes d'eau présentes dans le biogaz sont acides : ces gouttes sont un peu corrosives , il vaut donc mieux éliminer l'eau du biogaz.
Élimination du sulfure de dihydrogène. Afin d’éliminer également le sulfure de dihydrogène, on peut laver le gaz avec une solution contenant des amines. On utilise ici une solution de concentration c = 0,10 mol.L-1 en diéthanolamine (DEA) de formule HN(CH2CH2OH)2. La dissolution du sulfure de dihydrogène est similaire à celle du dioxyde de carbone. La constante vaut KH2S = 1,0.10-1. À l’aide de la constante KH2S, calculer la concentration en H2S(d) lorsque la solution est en équilibre avec le biogaz (H2S à 0,10 %, pression totale P = 10 bar). La pression partielle en H2S est constante par apport continu de biogaz. PH2S = fraction molaire H2S * pression totale = 10-3 P = 10-3 *10 = 0,010 bar. [H2S(d)] = KH2S PH2S/P° . c° = 0,10*0,010 ~ 1,0 10-3 mol/L. Écrire l’équation de la réaction entre le sulfure de dihydrogène et la DEA. Calculer sa constante K°. HN(CH2CH2OH)2 + H2S = H2N+(CH2CH2OH)2 +HS- ou DEA++ H2S =DEAH+ +HS- K° = [DEAH+][HS-] /([H2S][DEA]) couples acide / base : H2S /HS- ; Ka1 = 10-7 = [HS-][H3O+] / [H2S] DEAH+ /DEA : Ka2 = 10-9 = [DEA][H3O+] / [DEAH+] par suite K° =10-7 / 10-9 =100, valeur importante, la réaction est totale ; H2S est éliminé au fur et à mesure de sa formation.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|