|
cinétique d'oxydation : ion iodure et ion fer (III), chimie concours Mines 08
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Écrire l’équation bilan de l’oxydation des ions iodure par les ions fer(III), en affectant les espèces du fer du coefficient stoechiométrique 1. I- = ½I2 + e- : oxydation ; Fe3+ + e- = Fe2+ : réduction Fe3+ + I- = ½I2 + Fe2+. Si la concentration d’ions iodure passe de c0 à c0 – x entre 0 et t, on définit par rapport à x la vitesse volumique v de la réaction de la manière suivante : v = -d[I-]dt = dx/dt. On suppose une cinétique avec ordre, de constante de vitesse k ; on note a l’ordre partiel par rapport aux ions fer(III) et b l’ordre partiel par rapport aux ions iodure. Comment s’écrit la vitesse v ? Quelle est alors l’unité usuelle de k (au besoin en fonction de a et b) ? v = k[Fe3+]a[I-]b avec v en mol L-1 s-1et les concentrations en mol L-1. [k ]= mol L-1 s-1 mol-(a+b) La+b = mol-(a+b)+1 La+b-1 s-1. A la date t après le mélange d’une solution d’iodure de potassium avec une solution ferrique, on prélève à la pipette 5 mL de solution et on le dilue 10 fois avant de procéder à un dosage de la quantité d’iode formée. Justifier l’intérêt cinétique de cette dilution. En diluant on divise laes concentrations des réactifs par 10 : or les concentrations des réactifs sont un facteur cinétique ; la vitesse de la réaction est divisée par 10a+b. On réalise ainsi un blocage cinétique.
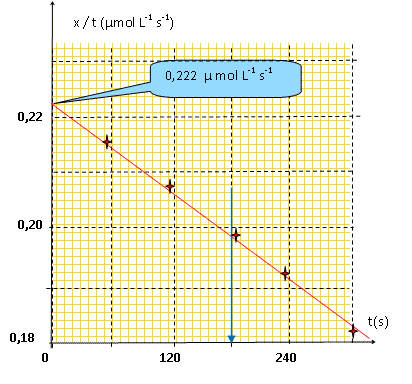
x(t) / t représente la vitesse moyenne de la réaction entre deux dates t2-t1 : les concentrations des réactifs diminuent au cours de la réaction : la vitesse diminue. Représenter graphiquement la grandeur x(t)/t en fonction de t ; en déduire une estimation de la valeur initiale (dx/dt)0.
Grâce à la méthode précédente, on détermine les valeurs initiales de (dx/dt)0 pour différentes concentrations initiales des deux réactifs. Quelques résultats sont présentés ci-dessous :
[dx/dt]0 = k[Fe3+]0a[I-]0b ; [I-]0 constante, si [Fe3+]0 double alors [dx/dt]0 double ; si [Fe3+]0 triple alors [dx/dt]0 triple : [dx/dt]0 et [Fe3+]0 sont proportionnelles ; a=1. [Fe3+] 0 constante, si [I-]0 est multipliée par 3, alors [dx/dt]0 est multipliée par 52/5,7 =9 ; si [I-]0 est multipliée par 4, alors [dx/dt]0 est multipliée par 354/22,5 ~ 16 d'où b = 2. v = k[Fe3+] [I-]02.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|