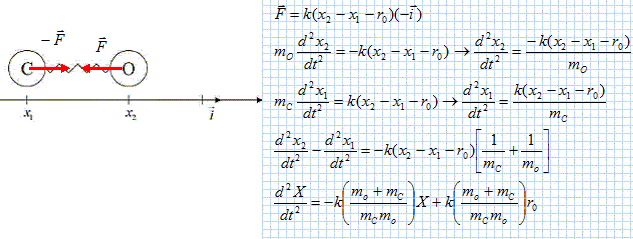|
La spectrométrie infrarouge, modèle harmonique de la liaison de valence concours général 2009.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
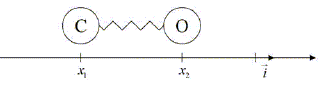
Il est également possible de fournir aux historiens de précieux renseignements sur les échanges commerciaux existant aux époques concernées. La spectrométrie infrarouge. Principe : La spectrométrie infrarouge s’utilise principalement pour l’analyse qualitative d’une molécule. Elle permet de mettre en évidence la présence d’une liaison particulière. Dans une molécule, les liaisons chimiques peuvent être décrites comme des ressorts liant les atomes. Lorsqu’une molécule absorbe de l’énergie sous la forme d’un rayonnement infrarouge, les atomes se mettent à vibrer. Ils entrent alors en oscillation. Considérons un atome de carbone de masse mC et un atome d’oxygène de masse mO reliés par une liaison covalente assimilable à un ressort à spires non jointives de constante de raideur k et de longueur à vide r0 . Ces atomes sont repérés par leurs abscisses respectives x1 et x2 (avec x1 < x2 ). On considérera que tous les déplacements s’effectuent sans frottements.
Faire un bilan des forces s’exerçant sur l’atome d’oxygène. Choisir judicieusement une origine pour l’axe repérant les positions des atomes et établir l’équation différentielle régissant l’évolution du mouvement de x2(t) . On choisit comme origine le centre de masse de la molécule CO On note r1 : position de C par rapport au centre de masse de la molécule CO et r2 : position de O par rapport au centre de masse de la molécule CO. mCx1 + mO x2 = 0 et on note r = x2-x1, la longueur du ressort. Le poids des atomes est négligeable devant la force de rappel F = - k (r-r0) = - k(x2-x1-r0-) Ecrire la seconde loi de Newton suivant l'axe horizontal :
Si l'atome de carbone est fixe x1 est constant et le premier membre de l'équation différentielle est l'équation différentielle d'un oscillateur harmonique. Déterminer l’expression de la période propre d’oscillation de ce mouvement. w02 = k/ mO ; w0 = 2 pi / T0 ; T0 = 2 pi ( mO/k)½. En réalité, l’atome de carbone n’est pas fixe et vibre également. Ecrire l’équation différentielle régissant l’évolution de x1(t). Ecrire l’équation différentielle régissant l’évolution de x2(t). On pose X =x2 -x1. Etablir l’expression l’équation différentielle vérifiée par X.
d2X/dt2=-k / µ (X-r0) ; d2X/dt2 + k/µ X = k/µ r0 avec W02 = k/µ. Déterminer la masse d’un atome de carbone puis la masse d’un atome d’oxygène. En déduire la valeur de la masse réduite. Que devient l’expression de la période propre d’oscillation ? En déduire la valeur de cette période puis la fréquence d’oscillation correspondante. (On donne pour cette liaison k= 3500N.m-1 ). En déduire la longueur d’onde du rayonnement nécessaire à l’excitation de cette liaison.
Pour réaliser le spectre infrarouge d’une molécule, on travaille avec des longueurs d’onde comprises entre 2,5 et 15 µm Lorsqu’une longueur d’onde l correspond à la fréquence d’excitation d’une liaison chimique, l’énergie du rayonnement est absorbée par la molécule. La mesure de l’intensité de lumière absorbée à chaque longueur l conduit à un spectre caractéristique du produit étudié ; ce spectre présentant des bandes d’absorption correspondant à l’excitation de certaines liaisons chimiques.
Le nombre d’onde s est la grandeur encore la plus couramment utilisée en spectrométrie. Il a l’avantage d’être directement proportionnel à la fréquence (donc à l’énergie) du rayonnement absorbé. s s’exprime comme l’inverse de la longueur d’onde l et s’exprime usuellement en cm-1. Déterminer la gamme de nombres d’onde possibles sur un spectre infrarouge. longueurs d’onde comprises entre 2,5 et 15 µm ( entre 2,5 10-4 m et 1,5 10-3 m) s est compris entre 1/2,5 10-4 =4000 cm-1 et 1 / 1,5 10-3 =667 cm-1. Justifier le fait que le nombre d’onde s soit proportionnel à la fréquence et donc à l’énergie du rayonnement absorbé. E = h n avec n : fréquence ; de plus n = c / l = c s d'où E = hc s.
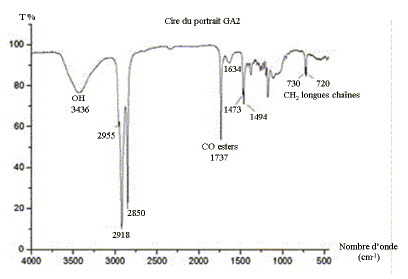
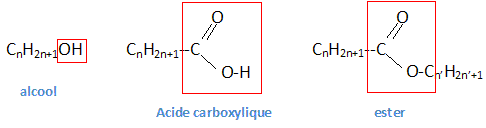
Application à l’étude du liant des portraits du Fayoum. La spectrométrie infrarouge se présente ainsi comme une technique d’analyse vibrationnelle. Elle permet l’analyse structurale fonctionnelle, c’est-à-dire la caractérisation de fonctions chimiques de produits organiques, inorganiques, cristallisés ou amorphes. Par comparaison avec les spectres d’absorption infrarouge de substances de référence, il est possible d’identifier une substance inconnue. Cette technique est notamment utilisée pour déterminer la composition de liants, matériaux constitutifs des oeuvres, provenant d’anciennes restaurations. Les portraits du Fayoum sont des représentations funéraires égyptiennes d’époque romaine (entre le Ier et le IVème siècle après Jésus Christ) peints avec un liant que l’on suppose être à base de cire d’abeille. Ces représentations étaient peintes sur panneaux de bois maintenus sur la momie par des bandelettes de lin ou peintes directement sur le linceul de lin enveloppant la momie. Le spectre infrarouge de ce liant est réalisé et l’on obtient :
|
|||||||
|
c |
|||||||
|
|