|
Autour de l'atome d'azote chimie concours DGCCRF 08
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
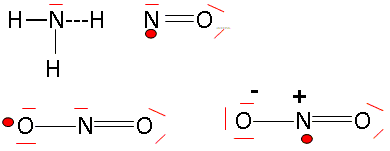
1s2 2s2 2p3 ou K2L5. Combien a-t-il d'électrons de valence ? 5 électrons externes sur la dernière couche occupée dans l'état fondamental. Quels sont les éléments situés juste avant et juste après l'azote dans la classification périodique ? 6C ( carbone ) ; 7N ( azote) ; 8O ( oxygène). Donner les formules de Lewis des molécules d'ammoniac, de monoxyde d'azote et de dioxyde d'azote.
Expliquer le principe de la théorie VSEPR ou théorie de Gillespie. La forme des édifices covalents (molécules ou ions) est déterminée par la répulsion existant entre les doublets électroniques de la couche de valence de l'atome central. On note : A : l'atome central dont il faut compter tous les électrons de valence X: atomes ou groupes d'atomes liés à l'atome central par des liaisons simples ou multiples. p : nombre de doublets liants ( doublets engagés dans une liaison) E : correspond aux doublets non liants ou libres q : nombre de doublets non engagés n = p+q : nombre total de doublets du cortège électronique de l'atome central notation générale A X p E q La forme géomètrique dépend du nombre de "volumes électronique" autour de l'atome central. - une liaison double, une liaison triple sont comptées pour un volume électronique, une liaison triple étant plus volumineuse qu'une liaison double. La répulsion entre les doublet est différente : * la répulsion est la plus grande entre 2 doublets non liants. * la répulsion est un peu moins grande entre un doublet liant et un doublet non liant * la répulsion est encore plus faible entre deux doublets liants. en conséquence les doublets non liants se placent de telle façon que la répulsion soit minimale : l'angle d'interaction sera le plus ouvert possible. Pyramide à base
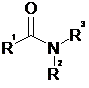
triangulaire. Présence d'un électron célibataire ( voir schémas ci-dessus). On se propose de synthétiser un amide en laboratoire. On donne ci-dessous la forme générale d'un amide :
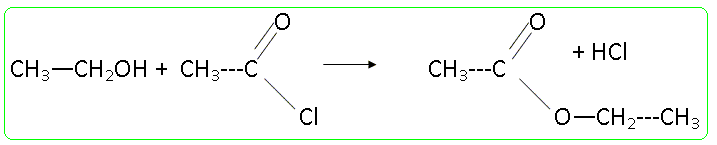
Ce type de composé peut être obtenu en faisant réagir une amine sur un chlorure d'acyle, le mécanisme étant de même type qu'un mécanisme d'estérification. Donner l'équation-bilan d'une réaction d'estérification en prenant un alcool et un chlorure d'acyle de votre choix.
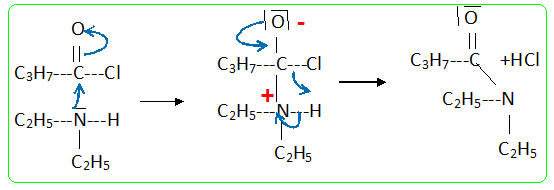
Quel danger dû aux sous-produits peut représenter cette réaction? Comment peut-on régler ce problème expérimentalement ? Dégagement d'un gaz le chlorure d'hydrogène : adapter au ballon un dispositif pour faire barboter ce gaz dans une solution d'hydroxyde de sodium. Quel intérêt peut-on avoir à utiliser un chlorure d'acyle plutôt qu'un acide carboxylique ? Quel autre dérivé d'acide peut-on utiliser ? Quel type de sous-produit forme-t-on dans ce cas ? La réaction d'un alcool sur un chlorure d'acyle est totale ; la réaction entre un alcool et un acide carboxylique est limitée par l'hydrolyse de l'ester. A la place du chlorure d'acyle on peut utiliser une anhydride d'acide : dans ce cas le sous produit est un acide carboxylique. On mélange 13 g de diéthylamine et 3,5 mL de chlorure de butanoyle dans 50 mL de dichlorométhane. La réaction se fait à froid (température d'environ 0°C) pendant 20 minutes. (C2H5)2NH : M = 73,14 g.mol-1 ; d = 0,7060 , pKa = 11 ; C4H9OCl : M = 106,6 g.mol-1 ; d = 1,026. C8H17NO : M = 143,23 g/mol-1. Ecrire l'équation bilan de réaction. Proposer un mécanisme en se basant sur le mécanisme d'estérification. (C2H5)2NH + C4H9OCl --> C8H17NO + HCl (1) Le mécanisme de la réaction débute par l’attaque du centre nucléophile de l’une des molécules sur le centre électrophyle de l’autre. Le carbone fonctionnel du chlorure d'acyle est déficitaire en électrons ( du fait du caractère électronégatif des atomes de chlore et d'oxygène) : ce carbone constitue un site électrophile. L'atome d'azote de l'amine porte un doublet libre et constitue un site nucléophile.
|
|||||||
|
|
|||||||
|
|
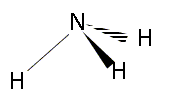 type
AX3E
type
AX3E