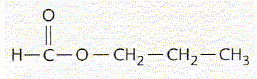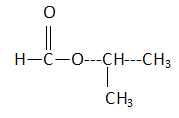|
estérification, saponification concours Fesic 2008
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||||||||||||||
| .
. |
||||||||||||||
|
||||||||||||||
|
De façon simplifée on peut écrire l’équation de la réaction de synthèse par : A + B = Y + W, A étant l’acide carboxylique et B l’alcool appropriés pour obtenir Y. Dans un ballon de 250 mL on introduit les espèces A et B, 4 gouttes de solution d’acide sulfurique concentré et quelques grains de pierre ponce (système S1). On chauffe à reflux jusqu’à l’obtention de l’état final.
A- Le méthanoate de méthyléthyle est isomère de Y. Vrai.
B- L’avancement final de la réaction est égal à 0,80 mol. Vrai. Lecture graphe n(Y) = 0,80 mol. Le ballon contenant S1 est maintenant équipé d'une colonne à distiller et d'un réfrigérant, permettant la récupération d'un distillat. En tête de colonne, un thermomètre permet de suivre la température des vapeurs. Celle-ci monte puis se stabilise pendant un certain temps puis monte à nouveau, on arrête alors le chauffage.
C- Le 1er palier de température correspond au changement d’état de l’ester. Vrai. Le composé le plus volatil ( température d'ébullition la plus faible) distille en premier. On considère un nouveau système S2, que l'on chauffe à reflux. S2 ne diffère de S1 que par une donnée : on introduit 2,4 mol de A au lieu de 1,2 mol. Quand l'équilibre est atteint, un dosage montre qu'il reste 1,4 mol de A. D- Le rendement de cette nouvelle synthèse est égal à 83 %. Vrai. Etat initial ( A : 2,4 mol ; B : 1,2 mol). 1 mol de A réagit avec 1 mol de B et donne 1 mol d'ester Y dans l'état final. Le rendement se calcule par rapport au réactif limitant B ( dans le cas d'une réaction totale ) 1*100/1,2 = 83 %.
A l’instant t = 0 s, on met en présence 1,0.10-3 mol d’éthanoate d’éthyle et la même quantité de matière d’hydroxyde de sodium. Le volume total du mélange, noté (S), est égal à 100 mL. Le tout est placé dans un bain thermostaté. A un instant t considéré, on prélève un volume V = 2,0 mL du mélange. Après avoir ajouté 50 mL d’eau glacée, on dose les ions hydroxyde restants par une solution d’acide chlorhydrique de concentration molaire en soluté apporté ca = 1,0 .10-3 mol.L-1 en présence de quelques gouttes de bleu de bromothymol.
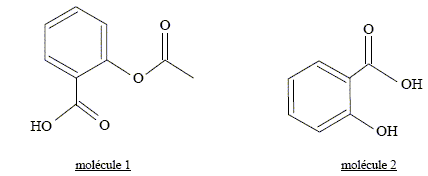
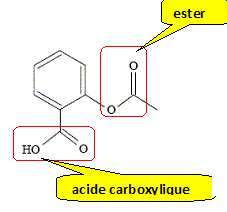
A- Lors de la synthèse, l’un des produits obtenus est de l’eau. Faux. CH3-COO-CH2-CH3 + HO- + Na+ = HO-CH2-CH3 + CH3-COO- + Na+. éthanoate de sodium + hydroxyde de sodium = alcool éthylique + éthanoate de sodium B- On ajoute de l’eau glacée dans le but de diluer le mélange. Faux. L'eau glacée réalise un blocage cinétique avant le dosage de la soude restante. A l’instant t considéré, le volume d’acide chlorhydrique versé pour atteindre le virage est égal à 6,0 mL. C- Lors du titrage, la solution passe du bleu au jaune. Vrai. Avant l'équivalence l'hydroxyde de sosium est en excès ( solution bleue) ; après l'équivalence l'acide chlorhydrique est en excès ( solution jaune). D- A l’instant t considéré, il s’est formé 0,70 mmol de chacun des deux produits dans le mélange (S). Faux. Quantité de matière (mol) : - d'acide chlorhydrique à l'équivalence : 6,0 *1,0 .10-3 = 6,0 10-3 mmol - d'hydroxyde de sodium dosé : 6,0 10-3 mmol - d'hydroxyde de sodium initial : 1,0.10-3 mol = 1 mmol - d'hydroxyde de sodium ayant réagi : 1-6,0 10-3 = 0,994 mmol Quantité de matière de chaque produit : 0,994 mmol
|
||||||||||||||
|
|
||||||||||||||
|
|