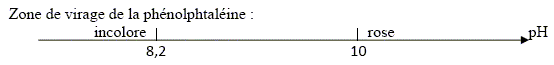|
Pile, électrolyse concours Fesic 2008
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
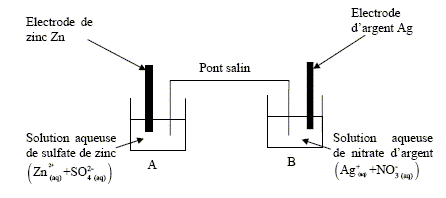
Lors du fonctionnement de la pile, la transformation est modélisée par l’équation de réaction : 2 Ag+(aq) + Zn(s) = 2 Ag(s) + Zn2+(aq) La constante de cette réaction K est égale à 7,6.1052. A- Le métal zinc Zn est le pôle positif de la pile. Faux. Le métal zinc s'oxyde et libère des électrons : c'est l'anode négative de la pile. Zn(s) = Zn2+(aq) + 2e-. B- Au pôle positif, on observe un dépôt d’argent. Vrai. L'argent constitue la cathode positive : les ions argent se réduisent en argent métallique. 2 Ag+(aq) +2e- = 2Ag(s) Le pont salin est constitué d’un papier absorbant imbibé d’une solution aqueuse de nitrate de potassium (K+ (aq) + NO3-(aq)). C- Les ions nitrate NO3-(aq) se déplacent du compartiment A vers le compartiment B. Faux. Dans le compartiment A des ions Zn2+(aq) apparaissent ; la solution A doit rester électriquement neutre : en conséquence des ions nitrate migrent du pont salin vers le compartiment A. Les deux compartiments contiennent initialement des solutions de même concentration c0 = 1,0.10–2 mol/L. Les métaux constituant les électrodes sont en excès. D- Lorsque la pile est usée, [Ag+]f = 5,0.10–3 mol/L. Faux. Le tableau suivant est étali pour un volume V = 1 L de chaque solution.
1,0.10-2 -2xfin~ 0 ; xfin~ 5,0.10-3 mol. [Zn2+]f ~1,5.10-2 mol/L.
Dans l'industrie monétaire, on cuivre une rondelle d'acier pour obtenir certaines pièces de monnaie comme les pièces de 1, 2 et 5 centimes d'euros. Le cuivrage s’effectue par électrolyse d’une solution aqueuse de nitrate de cuivre (II) de formule chimique : Cu2+(aq) + 2 NO3-(aq). L’une des électrodes de l’électrolyseur est constituée par un très grand nombre de rondelles à cuivrer, l’autre est en cuivre. Donnée : 1 Faraday : F = 96500 C.mol-1. A- Il s’agit d’une transformation forcée. Vrai. Une électrolyse est une transformation forcée : elle nécessite un apport d'énergie sous forme électrique B- Les rondelles d’acier se trouvent à l’anode de l’électrolyseur. Faux. Les rondelles doivent être recouvertes de cuivre métallique ; les ions Cu2+(aq) subissent une réduction. Une réduction se déroule à la cathode négative. C- La concentration de l’électrolyte en ions cuivre diminue pendant l’électrolyse. Faux. Les ions Cu2+(aq) subissent une réduction à la cathode et disparaissent de la solution. A l'anode le cuivre métallique s'oxyde en ion Cu2+(aq). La quantité de matière d'ion Cu2+(aq) reste donc constante. D- Une intensité de 1000 A doit circuler pendant 9650 s pour déposer 3,175 kg de cuivre sur les rondelles. Vrai. M(Cu) = 63,5 g/mol. n(Cu) =3175 / 63,5 =50 mol. Cu2+(aq) + 2e La charge d'une mole d'électrons vaut, en valeur absolue, 1Faraday = 96500 C. Quantité d'électricité : Q= 96500*100 = 9,65 106 C Q= It ; I =9,65 106 /9650 = 1000 A.
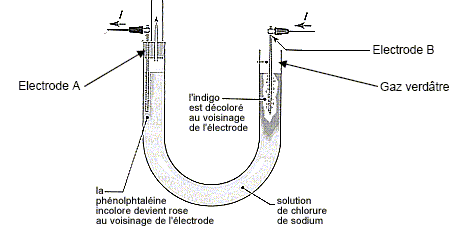
Le gaz verdâtre est du dichlore ; à l'électrode B, (anode positive) on observe l'oxydation des ions chlorures suivant : 2 Cl-(aq) = Cl2(g) + 2e-. (couple 4). B- La quantité de gaz formée à l’électrode A est double de celle formée à l’électrode B. Faux. A la cathode négative A, réduction de l'eau suivant : 2H2O(l) + 2e- = H2(g) + 2HO-(aq). (1) La quantité de matière de H2(g) est égale à celle de dichlore. C- La concentration des ions responsables du rosissement de la phénolphtaléine est égale à 1,0.10-1 mol/L. Vrai. Quantité de matière d'électron : 965 / 96500 = 1,0 10-2 mol. D'après (1) la quantité de matière d'ion hydroxyde HO- est égale à la quantité de matière d'électron soit 0,010 mol. [HO-(aq)] = n/V = 0,010 / 0,1 = 0,10 mol/L. D- On recueille 11 mL de gaz dans le tube disposé sur l’électrode A. Faux. D'après (1) la quantité de matière de dihydrogène est égale à la moitié de la quantité de matière d'électron soit 5,0 10-3 mol. volume H2(g) = n Vm = 5,0 10-3 *22 = 0,11 L = 1,1 102 mL.
|
||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||
|
|