|
Dosage par étalonnage des ions SCN- de la salive concours Capes interne 2009
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
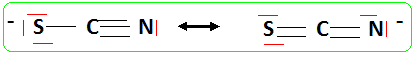
Donner le nom du complexe en nomenclature officielle. ion thiocyanatofer(III) Donner le schéma de Lewis de l'ion SCN-, les atomes sont liés dans cet ordre. Si plusieurs formules mésomères sont possibles, on les indiquera.
Déterminer la concentration en complexe Fe(SCN)2+ obtenue lorsqu'on réalise une solution de nitrate ferrique Fe(NO3)3 à 2,0 10-4 mol/L et de thioscyanate de potassium à la même concentration. On donne pour l'ion Fe(SCN)2+ pKd = 2,2 où Kd est la constante de dissociation. Fe3+ + SCN- = Fe(SCN)2+ K = 1/KD =102,2 = 158,5 = [ Fe(SCN)2+] / ([ SCN-][Fe3+])
x2-6,71 10-3x + 4 10-8 =0 ; x = 5,9 10-6 mol/L. On considère une solution de concentration initiale c0 =2,0 10-4 mol/L en ion SCN- et yc0 en ion ferrique. 158,5 = 99 /(yc0 -0,99
c0) ; 99/158,5 = (y -0,99 )c0
; 0,625 / 2,0 10-4 = y -0,99
; y = 3,1
103. On prépare la gamme d'étalonage suivante en introduisant dans les tubes numérotés 0 à 5 du nitrate ferrique en excès et du thiocyanate de potassium dans de l'acide nitrique dilué. Pour simplifier on donne directement la concentration c en complexe Fe(SCN)2+ présent dans chaque tube. Le tube 0 ne contient que du nitrate ferrique et de l'acide nitrique, dans des concentrations identiques à celles des tubes 1 à 5
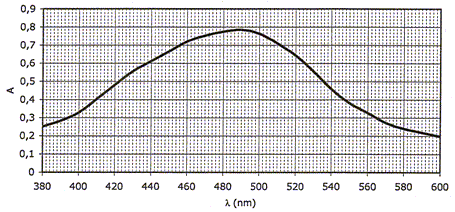
Que contient la solution placée dans la cuve pour réaliser le blanc ? Que est l'intérêt de la réalisation du blanc ? Faire le blanc, c'est faire une mesure d'absorbance, à la longueur d'onde choisie, en mettant dans la cuve uniquement le solvant ( eau et acide nitrique). Le spectrophotomètre le considèrera comme ligne de base (le zéro) pour les prochaines mesures. L'absorbance mesurée en suite sera uniquement due à l'epèce étudiée Fe(SCN)2+ Donner en justifiant la couleur de l'ion Fe(SCN)2+. A quelle longueur d'onde doit-on se placer pour réaliser les mesures d'absorbance par la suite ? Justifier. L'absorbance est maximum dans l'intervalle 440- 520 nm. La solution absorbe la partie bleu vert de la lumière blanche : elle diffuse la couleur complémentaire, le rouge. On choisit la longueur d'onde correspondant au maximum d'absorption l = 490 nm.
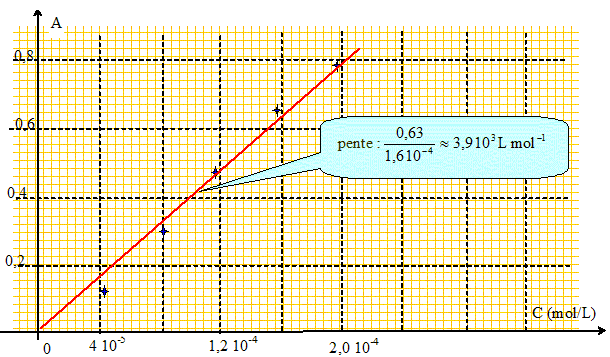
A cette longueur d'onde les résultats des mesures d'absorbance ( notée A) des différents échantillons sont récapitulés dans le tableau suivant :
Le graphe A = f(C) est une droite : la loi de Beer Lambert est vérifiée.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
0,128 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|