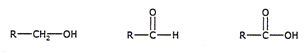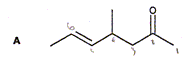|
Oxydoréduction en chimie organique concours Capes interne 2009
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
Nommer la fonction chimique présente dans les molécules suivantes ( R représente un groupe alkyle).
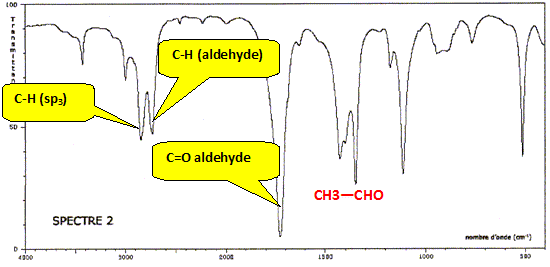
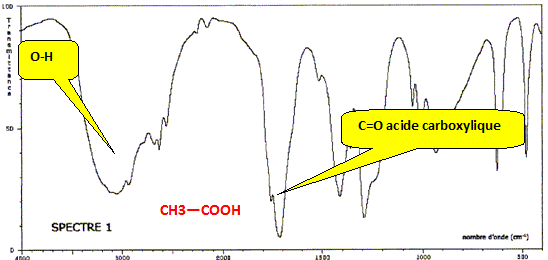
Dans l'odre : alcool primaire, aldehyde, acide carboxylique. Ecrire deux demi équations redox mettant en jeu ces différentes espèces. Préciser, à chaque fois, le rôle oxydant ou réducteur de chaque molécule. Couple oxydant / réducteur : RCHO / RCH2OH RCHO +2H+ +2e- = RCH2OH, l'oxydant RCHO se réduit. Couple oxydant / réducteur : RCO2H /RCHO. RCHO +H2O = RCO2H +2H+ +2e- le réduteur RCHO s'oxyde. Quelle particularité de l'espèce R-CHO met-on en évidence ? L'aldehyde joue un double rôle : oxydant ou réducteur. Les spectres IR des molécules précédentes pour lesquelles R est CH3 sont donnés. Attribuer à chaque molécule son spectre IR en s'appuyant sur des bandes d'absorption bien choisies.
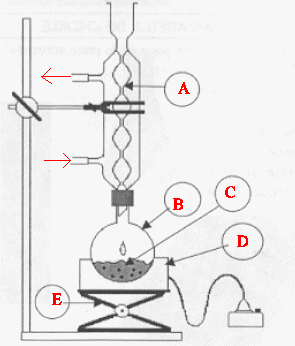
Oxydation de l'alcool benzylique. Une réaction couramment réalisée au lycée est l'oxydation de l'alcool benzylique en acide benzoïque. Quel réactif courant utilise t-on ? Ecrire le bilan de la réaction. L'oxydant utilisé est l'ion MnO4-. En milieu acide, l'acide benzoïque est peu soluble ( il serait difficile de le séparer de MnO2 ) et il pourrait réagir avec l'alcool benzylique pour former un ester. 3 fois { C6H5CH2OH + 5 HO- = C6H5CO2- + 4 e- + 4H2O } 4 fois { MnO4- + 3 e- +2H2O = MnO2+ 4 HO- }. 3 C6H5CH2OH + 4 MnO4- = 3 C6H5CO2- + 4 MnO2 + HO- + 4 H2O. Cette réaction est effectuée à reflux du solvant. Présenter un schéma du montage à reflux.
A : réfrigérant à eau ; : ballon ; D : chauffe ballon ; E : élévateur à croisillons. Le chauffage à reflux permet d'accérer la réaction en travaillant à température modérée, tout en évitant les pertes de matière : les vapeurs se condensent dans le réfrigérant et retombent dans le ballon. L'acide benzoïque synthétisé est purifié par recristallisation. Le solvant de recristallisation est l'eau. Expliquer le principe d'une recristallisation et décrire le protocole opératoire mise en oeuvre. Elle permet de séparer l'acide benzoïque des impuretés en jouant sur la différence de solubilité de l'acide benzoïque et des impuretés dan un solvant. On dissout l'ensemble à chaud dans le volume miminum de solvant, puis on laisse refroidir. L'acide benzoïque cristallise alors que les impuretés doivent rester dans le solvant. Quelle caractérisation simple peut-on effectuer pour vérifier la pureté de l'acide benzoïque synthétisé ? Mesure du point de fusion ou chromatographie sur couche mince. Citer une utilisation courante de l'acide benzoïque. Conservateur alimentaire.
Réduction de la fonction carbonyle par le dihydrogène. A température suffisamment élevée et sous une pression de plusieurs bars, en présence de catalyseur, les fonctions carbonyles peuvent être réduites en alcool par l'hydrogène. Ecrire le bilan de la réaction dans le cas de la propanone. CH3-CO-CH3 + H2 = CH3-CH(OH)-CH3 Ce traitement n'est pas sélectif et réduit également les liaisons C=C. On envisage cette hydrogénation catalytique de la molécule A suivante :
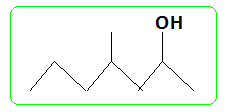
Nommer cette molécule. 4-méthylhept-5-èn-2-one. Donner la représentation topologique du produit B de la dihydrogénation catalytique de A.
|
||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||
|
|