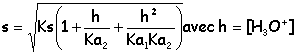|
Le nickel Sabatier, propriétés acido-basiques des ions carbonates concours chimie Capes 2009.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Puis s'intéressant plus en détail à l'action du nickel, il note son action catalytique, et propose une méthode permettant d'obtenir du nickel pur et finement divisé : le " nickel de Sabatier". Ce catalyseur est obtenu en deux étapes à partir du carbonate de nickel : - dissociation thermique du carbonate de nickel : NiCO3(s) = NiO(s) + CO2(g) (1) - réduction de l'oxyde de nickel : NiO(s) + H2(g) = Ni(s) + H2O(g) (2). Etude thermodynamique de l'étape (1).
DrH° = DfH°(CO2(g)) +DfH°(NiO(s)) -DfH°(NiCO3(s)) = -393-240+680 =47 kJ mol-1 DrS° = S°(CO2(g)) +S°(NiO(s)) -S°(NiCO3(s)) = 214+38-118 =134 J mol-1K-1 DrG° =DrH° -TDrS° =47000-298*134 = 7068 kJ mol-1. DrG° = -RT ln K1 ; K1 = -7068 /(8,31*298) =0,058. Si on se place dans les conditions standards en présence de NiCO3(s) et de NiO(s), quel est le sens d'évolution spontané du système ? L'affinité est négative A = -DrG° = -7068 ; évolution spontanée dans le sens indirect, vers la gauche. Prévoir dans quel sens l'équilibre (1) est déplacé lors d'une augmentation de pression à température constante, le système étant fermé. Evolution dans le sens d'une diminution du nombre de molécules de gaz, donc dans le sens indirect. Prévoir dans quel sens l'équilibre (1) est déplacé lors d'une élévation de température à pression constante, le système étant fermé. La réaction étant endothermique dans le sens direct, elle est favorisée par une élévation de température. Etude thermodynamique de l'étape (2) indépendamment de l'étape (1). La variance est le nombre de paramètres
intensifs indépendants. La règle des phases donne la variance
d'un système thermodynamique : v = c+2-j c : nombre de constituants indépendants (
nombre de constituants - nombre de réactions
chimiques indépendantes entre ces
constituants) ; c =4-1 = 3 la pression et la température sont des
facteurs pouvant modifier l'équilibre. j : nombre de phases présentes ( deux
solides et un gaz ). j = 3 v= 3+2-3 = 2
; on peut faire varier la
température et la pression. Déterminer les valeurs des pressions partielles en dihydrogène et vapeur d'eau à l'équilibre si T=573 K et Ptot = 1,5 bar. NiO(s) + H2(g) = Ni(s) + H2O(g) (2). K2 = PH2O / PH2. avec PH2O , pression partielle de la vapeur d'eau et PH2 , pression partielle du dihydrogène.
Fraction molaires xH2 = n2-x / n2 ; xH2O = x / n2 ; PH2O = x / n2 Ptot ; PH2 = n2-x / n2 Ptot. K2 = x / (n2-x ) ; 530(n2-x ) = x ; 530 n2 = 531 x ; x = 0,998 n2. PH2O = x / n2 Ptot = 0,998*1,5 =1,497 bar et PH2 =2,8 10-3 bar. Etude du précurseur : le carbonate de nickel NiCO3(s). On donne à 298 K : pKa1(CO2 aq / HCO3-aq) = 6,3 ; pKa2( HCO3-aq /CO32-aq) =10,3. Le précurseur utilisé lors de la préparation du nickel Sabatier est le carbonate de nickel NiCO3(s). C'est un sel peu soluble dont le produit de solubilité est pKs = 8,2 à 298 K. On se propose d'étudier l'influence du pH sur la solubilité ainsi que les propriétés acido-basiques des ions carbonates. On considère dans cette partie que l'hydroxyde de nickel ne précipite pas. Calculer la solubilité s ( mol/L) du carbonate de nickel dans une solution dont le pH est fixé à 12. NiCO3(s) = Ni2+aq + CO32-aq. Ks = [Ni2+aq][CO32-aq] = s [CO32-aq] Les formes prédominantes de l'élément carbone à pH = 12 sont : HCO3- et CO32- . s = [HCO3- ]+[CO32- ] = [Ni2+] (1) HCO3- + H2O = CO32- + H3O+ ; Ka2 = [H3O+][CO32-] /[HCO3-] [CO32-] /[HCO3-] = Ka2 /[H3O+] =10-10,3 / 10-12 = 101,7 = 50 ; [CO32-] = 50[HCO3-] (1) s'écrit : s = 51 [HCO3-] = [Ni2+] soit [HCO3-] = s/51 = 1,961 10-2 s; [CO32-] =0,980 s ; Ks =10-8,2 = 0,98 s2 ; s = 8,0 10-5 mol/L.
Soit s' la solubilité du carbonate de nickel dans une solution dont le pH est maintenu à 12 et qui contient 0,50 mol/L d'ion nickel. Comparer s' et s en justifiant. Calculer s'. s' ~ [CO32-] ; [Ni2+] = 0,5 + s' ; Ks = (0,5+s') s' ~ 0,5 s' ; s' = 1,3 10-8 mol/L. La solubilité diminue par effet d'ion commun. On ajoute un acide fort dans une solution de carbonate de nickel. Expliquer qualitativement l'évolution de la solubilité de NiCO3 lorsque le pH diminue. ( on supposera qu'il n'y a pas de dégagement de CO2). NiCO3(s) = Ni2+ + CO32- ; Ks =[Ni2+][CO32-]total s=[Ni2+]=[CO32-] + [HCO3-] + [CO2,H2O] ; Ks =s ( [CO32-] + [HCO3-] + [CO2,H2O])
Si le pH augmente, h diminue et en conséquence : Ks, Ka1 et Ka2 étant constants à température constante)
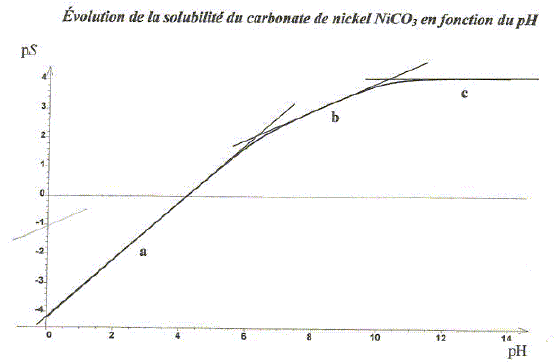
Retrouver les pentes des droites a, b et c. A pH très élevé, les termes h/ Ka2 et h2/( Ka1 ka2) sont négligeables devant 1 : s~ Ks½ = 10-4,1 ; ps = 4,1, valeur constante, droite horizontale de pente nulle. A pH compris entre 7 et 9, les termes 1 et h2/( Ka1 ka2) sont négligeables devant h/ Ka2 : s~ (Ksh/ Ka2)½ = (102,3 h )½; log s = 0,5 *2,3 + 0,5log h ; ps = -1,15 +0,5 pH, droite de pente 0,5. pH < 5, les termes 1 et h/ Ka2 sont négligeables devant h2/( Ka1 ka2) : s~ (Ksh2/ ( Ka1 ka2) )½ = 104,2 h; log s = 4,2 + log h ; ps = -4,2 + pH, droite de pente 1.
La précipitation d'un sel peu soluble contenant des ions carbonate intervient aussi lorsque l'eau de chaux se trouble. Comment fabrique t-on l'eau de chaux ? Quels ions contient -elle ? Le lait de chaux est obtenu en mélangeant dans un bécher un peu de chaux éteinte ( solide blanc) avec 100 mL d'eau. Laisser décanter ; filtrer : le filtrat obtenu est l'eau de chaux contenant les ions Ca2+aq et HO-aq. Que met-on en évidence lors du trouble ? Quelle est la formule chimique du précipité ? On met en évidence le dioxyde de carbone par barbotage ; précipité CaCO3.
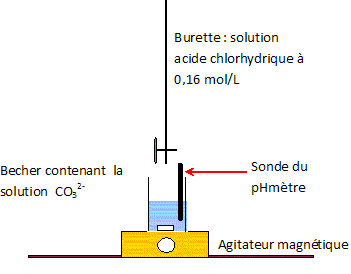
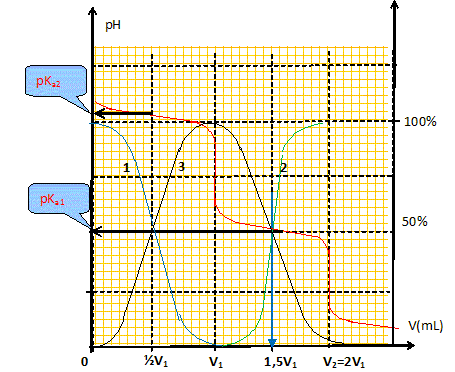
CO32- aq + H3O+aq = HCO3-aq + H2O ; K = 1/Ka2 = 1010,3. HCO3-aq + H3O+aq = CO2, H2O + H2O ; K = 1/Ka1 = 106,3. Définir l'équivalence d'un dosage. Avant l'équivalence, l'un des réactifs est en excès ; après l'équivalence, l'autre réactif est en excès. A l'équivalence, les quantités de matière (mole) des réactifs mis en présence sont en proportions stoechiométriques. Déterminer graphiquement la valeur de chacun des deux volumes équivalents V1 et V2 et en déduire cb. Méthode des tangentes ; cb = ca V1 / Vb = 0,160 / 10 * V1 avec V1 en mL.
Retrouver par le calcul la valeur du pH initial de la solution d'ion carbonate de concentration cb. Réaction prépondérante : CO32- aq + H2O = HCO3-aq +HO-aq ; K = [HCO3-aq][HO-aq] / [CO32- aq] K =[ HO-aq] [ H3O+aq] [HCO3-aq] / ( [CO32- aq][ H3O+aq])= 10-14 / 10-10,3 = 2 10-4, réaction très limitée. Le tableau suivant est réalisé pour un volume V = 1 L.
x = (2 10-4 * 0,1 )½ =4,5 10-3 mol/L ; [ H3O+aq] = 10-14 / (4,5 10-3)=2,2 10-12 mol/L ; pH = 11,7. L'hypothèse x<<cb est bien vérifiée. Retrouver par calcul la valeur du pH à la première équivalence du dosage. Réaction prépondérante : HCO3-aq + H2O = CO2, H2O + HO-aq ; K = [CO2, H2O][HO-aq] / [HCO3-aq] K =[ HO-aq] [ H3O+aq] [CO2, H2O] / ( [HCO3-aq] [ H3O+aq])= 10-14 / 10-6,3 = 2 10-8, réaction très limitée. Le tableau suivant est réalisé pour un volume V = 1 L.
x = (2 10-8 * 0,1 )½ =4,5 10-5 mol/L ; [ H3O+aq] = 10-14 / (4,5 10-5)=2,2 10-10 mol/L ; pH = 9,7. L'hypothèse x<<cb est bien vérifiée.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|