|
Généralités sur les hydrogénations concours chimie Capes 2009.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||
| .
. |
|||||||||
|
|||||||||
|
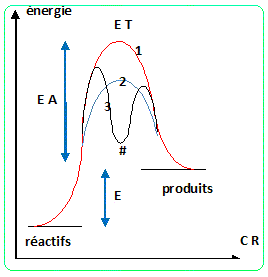
Un catalyseur augmente la vitesse d'une réaction sans intervenir dans le bilan global. Donner le diagramme d'énergie potentielle d'une réaction A-->B ( supposée élémentaire et endothermique) non catalysée, et la même réaction catalysée. Y faire apparaître le ( ou les )état(s) de transition, le (ou les) intermédiaire(s) réactionnel(s) ainsi que les différentes grandeurs énergétiques. On met en abscisse CR, que signifie CR ?
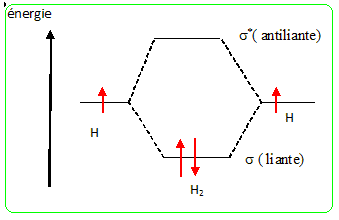
Définir la catalyse hétérogène et rappeler les principales étapes d'un mécanisme en catalyse hétérogène. Le catalyseur est à l'état solide, la phase réactive est liquide ou gazeuse. - Adsorption des réactifs à la surface du catalyseur - quand toutes les nouvelles liaisons sont réalisées, le produit peu adhérent au catalyseur se détache de celui-ci par simple agitation thermique - le catalyseur est d'autant plus efficace que sa surface par unité de masse est grande. Les métaux de transition sont les
éléments qui possèdent une
sous-couche d partiellement remplie. Définition moins stricte : le terme
transition se réfère aux
éléments situés entre le
groupe 2 et le groupe 13 du tableau
périodique. Définir la notion de complexe. Expliquer pourquoi l'utilisation de ce catalyseur implique une catalyse homogène. Un complexe est un édifice polyatomique constitué d'un cation ou d'un atome central, entouré de plusieurs ligands ( molécules ou ions ) ; ces derniers délocalisent une partie de leur densité électronique sur le cation ou l'atome central, formant ainsi des liaisons chimiques avec celui-ci. Une catalyse est dite homogène lorsque le catalyseur ne forme qu'une seule phase avec les réactifs : c'est le cas du catalyseur de Wilkinson, soluble dans les solvants organiques. Les alcènes. Comment l'éthène et le propène sont-ils obtenus dans l'industrie ? éthylène : à partir du naphta provenant de la distillation fractionnée du pétrole (Europe) par vapocraquage ; à partir de gaz naturel riche en éthane (USA) par pyrolyse ou craquage à température élevée. Propène : craquage catalytique dans les raffineries, déshydrogénation du propane. La polymérisation par voie radicalaire de l'éthène fornit environ la moitié du tonnage mondial de popyéthylène. Le polymère obtenu par cette méthode n'est pas entierement linéaire mais légèrement ramifié, il est appelé "polyéthylène basse densité" ou PEBD. Quels sont les noms des différentes étapes de ce mode de polymérisation ? Comment s'explique l'apparition des ramifications ? Amorçage : RO-OR --> 2 RO. ; RO. +CH2=CH2 --> RO-CH2-CH2.. Propagation : RO-CH2-CH2. + CH2=CH2 --> RO-CH2-CH2-CH2-CH2.. RO-CH2-CH2. + nCH2=CH2 --> RO-[CH2-CH2]n-CH2-CH2. . Terminaison : RO. + RO. =RO-OR par exemple. Des ramiffications se créent à la suite de l'arrachement d'un hydrogène tout au long de la chaîne de croissance par un centre radicalaire, suivi de l'apparition d'une nouvelle chaîne au niveau de ce nouveau radical.
L'autre moitié de la production mondiale de polyéthylène est obtenue par polymérisation par coordination. Celle-ci s'effectue à température ambiante et pression atmosphérique sur catalyseur à base d'aluminium et de titane. ( Ziegler et Natta, prix Nobel 1963) Le polymére obtenu est parfaitement linéaire, il est nommé " polyéthylène haute densité " PEHD. Justifier l'influence de la structure sur la densité. Dans le cas d'un polymère linéaire, les chaînes peuvent se coller les unes aux autres par interaction de Van Der Waals : ce polymère est dense. Cela n'est pas possible en présence de ramifications, les chaînes étant plus éloignées : le polymère est moins dense. Le propène est aussi polymérisé par catalyse de coordination et le polypropylène obtenu est isotactique. Que signifie le terme isotactique ? Les substituants sont tous du même côté de la chaîne du polymère.
|
|||||||||
|
|
|||||||||
|
|