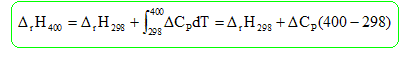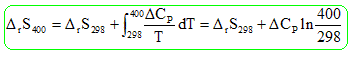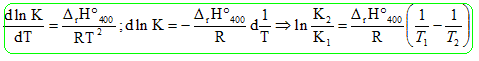|
étude
thermodynamique de la synthèse de l'éthanol
concours chimie Capes
2007.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On fait réagir en phase gazeuse de l'éthylène avec de la vapeur d'eau pour produire l'éthanol. Cette réaction conduit à un état d'équilibre. C2H4(g) + H2O(g) = C2H5OH(g). La constante d'équilibre associée à cette réaction est notée K0. Etat standard : L'état standard correspond au corps pur dans son état physique le plus stable à la température T, sous la pression standard : p0 = 1 bar = 105 Pa. Variance du système : La variance est le nombre de paramètres intensifs indépendants. La règle des phases donne la variance d'un système thermodynamique : v = c+2-j. Le chiffre 2 indique le nombre de paramètres intensifs, température et pression. c : nombre de constituants indépendants ( nombre de constituants - nombre de réactions chimiques indépendantes entre ces constituants) Nombre de constituants : c=3 ; nombre de relation : 1 ; nombre de phase : j=1, une seule phase gazeuse. v = c-1+2-j= 3-1+2-1 =3. Ceci signifie que la connaissance de trois paramètres suffit à connaître les proportions de l'équilibre. On choisit dans ces facteurs, par exemple, T, P, P(H2O) Relation entre les pressions partielles des constituants et K0.
DrH°298
=DrH°(C2H5OH(g))
-DrH°(H2O(g))-DrH°(C2H4(g)) DrH°298
=
-235,1 +241,8-52,5 = -45,8 kJ / mol. DCP
=65,4-33,6-43,6 = -11,8 J mol-1
K-1 DrH400
= -45,8 103 - 11,8*102
= -47,0
kJ/mol.
Relation entre K, a, Ptot.
Fractions molaires :
0,246 ( 1-a)2 = a(2-a) ; 1,246 a2-2,498 a+0.246 = 0 ; a =0,104 ( 10,4 %). On veut étudier l'influence de la température sur l'équilibre précédent. Dans quel sens l'équilibre précédent est déplacé lors d'une élévation de température à pression constante, le système étant fermé. DrH400 est négatif : la réaction est exothermique. Une élévation de température favorise une réaction endothermique : l'équilibre est déplacé dans le sens indirect ( vers la gauche). On élève la température de 150 K à partir de 400 K. Déterminer la valeur de la nouvelle constante d'équilibre et la valeur du coefficient de dissociation a. On suppose que DrH400 est à peu près constant sur l'intervalle de température et on utilise la relation de Vant'Hoff :
ln (K2/0,246 ) = -47 103 / 8,314 [ 1/400 -1/550] = -3,85 ; K2 = 0,246 *0,021 =5,2 10-3. Autre méthode : en refaisant le calcul ci-dessus ou trouve 5,56 10-3. Calcul de a à 550 K sour Ptot = 1,00 bar. 5,56 10-3 ( 1-a)2 = a(2-a) ; 1,0056 a2-2,0112 a+0,0056 = 0 ; a =0,028 ( 2,8%).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|