|
acide benzoïque, préparation, solubilité, acide base : concours Capes interne 2004
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
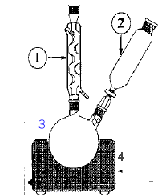
En milieu acide, l'acide benzoïque est peu soluble ( il serait difficile de le séparer de MnO2 ) et il pourrait réagir avec l'alcool benzylique pour former un ester. 3 fois { C6H5CH2OH + 5 HO- = C6H5CO2- + 4 e- + 4H2O } 4 fois { MnO4- + 3 e- +2H2O = MnO2+ 4 HO- }. 3 C6H5CH2OH + 4 MnO4- = 3 C6H5CO2- + 4 MnO2 + HO- + 4 H2O. Dans un ballon bicol de 250 mL rodé, on introduit 2,00 mL d’alcool benzylique, quelques grains de pierre ponce et 20 mL d’une solution d’hydroxyde de sodium à 2,0 mol.L-1. On équipe le ballon d’un réfrigérant à eau, et d’une ampoule de coulée contenant 100 mL d’une solution de permanganate de potassium à 0,3 mol.L-1. On chauffe à ébullition douce grâce à un chauffe-ballon placé sur un support élévateur puis on introduit lentement ( en 15 minutes environ ) la solution oxydante. Un précipité marron apparaît dans le ballon. On poursuit le chauffage 10 minutes après la fin de l’addition puis on laisse refroidir le contenu du ballon. Par le haut du réfrigérant, on ajoute quelques gouttes d’éthanol jusqu’à disparition totale de la couleur violacée dans le ballon. On filtre ensuite le contenu du ballon sur büchner. 1 : colonne Vigeux ou réfrigérant
droit 2 ampoule de coulée 3 : ballon bicol 4 : chauffe ballon. Calcul des quantités initiales de
matière : alcool benzylique ( densité de
l’alcool benzylique : 1,04 ; M =108 g/mol
: m = 2,00*1,04 = 2,08 g ; n = m/M = 2,08/108
=1,93 10-2 mol. KMnO4 : 0,3 *0,100 = 3
10-2 mol.
Si MnO4- est en défaut : 3 10-2 -4 xmax =0 ; xmax=7,5 10-3 mol. On retient la plus faible valeur : C6H5CH2OH est en défaut ; MnO4- est en excès. réduction excès ion permanganate : Connaissant les couples oxydant-réducteur mis en jeu : CH3CO2H(aq) / CH3CH2OH(aq) et MnO4- / MnO2 , l’équation de la réaction interprétant la disparition de la teinte violacée lors de l’ajout d’éthanol à 95° s'écrit : 4 fois{ MnO4- + 3e- + 2H2O = MnO2 + 4 HO- }( réduction) 3 fois{ CH3CH2OH + 5 HO- = CH3COO- + 4e- + 4H2O } ( oxydation) 4 MnO4- + 3 CH3CH2OH --> 4 MnO2 + 3CH3COO- + 4 H2O +HO-
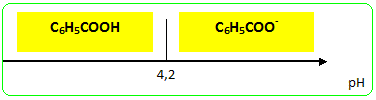
Précipitation de l’acide benzoïque et purification. On verse le filtrat dans un becher de 250 mL refroidi dans la glace pilée. Sous la hotte et muni de gants et de lunettes, on verse lentement 10 mL d’une solution d’acide chlorhydrique concentré. L’acide benzoïque précipite sous forme d’un solide blanc ; on refroidit énergiquement le mélange réactionnel afin que la précipitation soit quasiment achevée. On filtre ensuite l’ensemble sur büchner en lavant les cristaux avec le minimum d’eau glacée. On essore bien les cristaux et on place ensuite l’acide benzoïque à l’étuve à 80°C. On pèse ensuite le solide sortant de l’étuve. On identifie l’acide benzoïque en mesurant son point de fusion ( banc Kofler). En présence d'acide chlorhydrique l'ion benzoate, soluble dans l'eau conduit à l'acide benzoïque C6H5 COO- + H3O+ =>C6H5 COOH + H2O réaction acide base. L'acide benzoïque ( le groupe C6H5 a peut d'affinité pour l'eau) est d'autant moins soluble dans l'eau que la température est plus basse. Par contre l'ion benzoate possèdant le groupe chargé COO- est soluble dans l'eau, solvant polaire. L'acide benzoïque peut être purifié par recristallisation. Rendement = masse réelle / masse théorique calculée à partir de 1,93 10-2 mol d'alcool benzylique on peut théoriquement obtenir 1,93 10-2 mol d'acide benzoïque masse molaire C6H5 COOH : 7*12+6+32 = 122 g/mol masse théorique : 122 *1,93 10-2 = 2,35 g Banc Kofler : mesure du point de fusion d'un solide Plaque métallique chauffée par un dispositif électrique ; d'une extrémité à l'autre de la plaque s'établit un gradient de température. On étalonne cette plaque avec un ou deux échantillons dont on connaît parfaitement la température de fusion. On dépose quelques cristaux du produit ( dont on désire connaître la température de fusion ) sur la partie la plus froide de la plaque, puis on déplace ces cristaux vers la parite chaude, jusqu' à fusion de ces derniers.
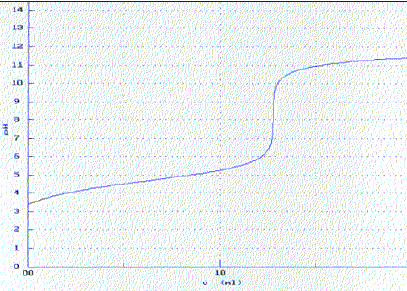
Solubilité de l'acide benzoïque. L’hydroxyde de sodium est un solide blanc déliquescent ( qui absorbe l’eau atmosphérique et s’y dissout ) très soluble dans l’eau. Ce produit présente le risque codifié R35 : provoque de graves brûlures. L’acide benzoïque est, comme nous l’avons vu précédemment, un solide blanc peu soluble dans l’eau froide. Le bleu de bromothymol est un indicateur coloré acido-basique qui vire du jaune au bleu quand le pH varie entre 6,0 et 7,6. Préparations des solutions et dosage de la solution d’hydroxyde de sodium. On pèse, à l’aide d’une balance, 0,40 g d’hydroxyde de sodium solide que l’on dissout dans laquantité d’eau nécessaire à l’obtention de 500 mL d’une solution notée S1. On pèse 0,40 g d’acide benzoïque que l’on verse dans environ 100 mL d’eau. On agite pendant quinze minutes et on filtre. Le filtrat constitue la solution d’acide benzoïque notée S2. On dose 10,0 mL de la solution S1 de concentration Cb par une solution d’acide chlorhydriquede concentration 0,010 mol.L-1 en présence de bleu de bromothymol. Le virage de l’indicateur est obtenu pour un volume de solution d’acide chlorhydrique versé VE1 = 18,3 mL. Précautions à prendre lors de la préparation de la solution S1 : port de gants, blouse et lunettes. Equation de la réaction de dosage de la solution S1 par la solution d’acide chlorhydrique : H3O+ + HO- = 2 H2O K = 1014, valeur importante, la réaction est totale. Relation entre les quantités de matière à l’équivalence : Va Ca = VE1 Cb ; Cb = VE1 Ca /Vb = 18,1*0,010 / 10,0 =1,81 10-2 mol/L Comparaison avec la valeur théorique en calculant l’écart relatif : n = 0,40 / 40 = 0,01 mol dans 0,5 L ; C = 0,01/0,5 = 0,02 mol/L. (0,02-0,018) / 0,02 ~ 0,1 ( 10%) La solution de soude n'est pas fraichement préparée, elle a réagi avec le dioxyde de carbone de l'air. Le bleu de bromothymol est un indicateur bien adapté pour ce dosage : sa zone de virage contient le pH du point équivalent ( pH=7). Dans le becher, avant l'équivalence, la soude est en excès ( le BBT est bleu) ; après l'équivalence, l'acide est en excès ( le BBT est jaune).
En admettant que cette solution soit effectivement saturée, calculons la solubilité de l’acide benzoïque, en g.L-1 à la température de l’expérience 293 K. Ca * M ( acide benzoïque) = 2,3 10-2 *122 =2,8 g/L. Afin de vérifier la valeur de la solubilité
on procède à l’expérience suivante
: on introduit, dans un becher, 100 mL d’une solution
aqueuse de benzoate de sodium, de concentration massique 50
g.L-1. On verse dans la solution, à
l’aide d’une burette, une faible quantité
d’acide chlorhydrique concentré en
contrôlant le pH jusqu’à ce qu’il
soit égal à 2,0 ( on négligera la
dilution ). On observe l’apparition d’un
précipité.
Calculons la valeur du pH de la solution initiale de benzoate de sodium. C6H5 COO- +H2O =C6H5 COOH +HO- ; K' = 1/K=10-9,8=1,6 10-10. M(C6H5 COO- Na+) =144 g/mol ; n0(C6H5 COO- Na+) = 50/144*0,1 =3,47 10-2 mol
K' = 1,6 10-10 = 10xf2/(3,47 10-2 - xf) ; 1,6 10-10 (3,47 10-2 - xf) = 10xf2. xf2 +1,6 10-11xf -5,55 10-13 = 0 ; xf ~7,45 10-7 mol. [HO-]f =7,45 10-6 mol/L ; [H3O+]f =10-14/7,45 10-6 =1,34 10-9 mol/L; pH =-log (1,34 10-9 ) =8,9. Calculons la valeur de la concentration massique (en g.L-1) en acide benzoïque à pH = 2,0 en considérant que l’acide n’a pas encore précipité.
K" = 104,2 = 1,6 104 =xf / (0,01 (3,47 10-2 - xf)) ; 160(3,47 10-2 - xf) =xf ; xf =3,45 10-2 mol [C6H5 COOH]f =0,345 mol/L soit 0,345*122 = 42 g/L Valeur bien supérieure à la solubilité ( 2,8 g/L à 293 K) : l’acide benzoïque précipite dans le becher. Calculons la masse d’acide benzoïque précipité à 293 K en utilisant la valeur de la solubilité calculée à la question précédente. solubilité de l'acide benzoïque : 2,8 g/L Conservation de l'élément carbone : [C6H5 COOH]f + [C6H5 COO-]f = 50 g/L [C6H5 COO-]f =50-2,8 = 47,2 g/L soit 4,7 g dans 100 mL.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|