|
La chimie verte : enjeux et objectifs, Bts chimie 2009 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Données : Les gaz sont assimilés à des gaz parfaits. Constante des gaz parfaits : R = 8,31 J.K-1.mol-1. 8O : 16,0 ; 7N : 14,0 g/mol.
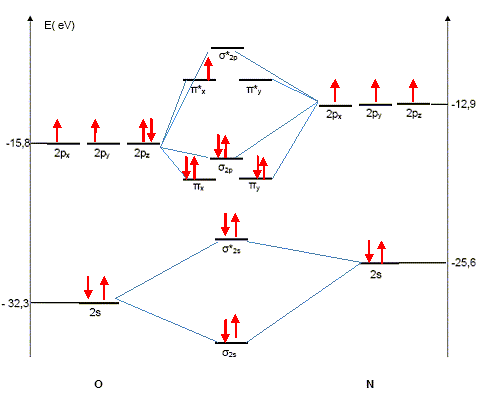
Etude des pluies acides. Les principaux polluants sont les composés dits NOx, c’est-à-dire les oxydes d’azote, majoritairement NO et NO2. Donner les configurations électroniques d’un atome d’azote et d’un atome d’oxygène pris dans leur état fondamental. Préciser le nombre d’électrons de valence pour chacun de ces atomes. Oxygène : 1s2 2s2 2p4 : 6 électrons externes ou de valence. azote : 1s2 2s2 2p3 : 5 électrons externes ou de valence. Représenter un schéma de Lewis possible pour la molécule de monoxyde d’azote.
Compléter le diagramme d’orbitales moléculaires du monoxyde d’azote dans son état fondamental,.
Calculer l’indice de liaison du monoxyde d’azote. Cette molécule est-elle diamagnétique ou paramagnétique ? Justifier. Cet indice est défini de la manière suivante : i = 1(n-n*) n : nombre d'électrons dans les orbitales liantes n* nombre d'électrons dans les orbitales non liantes. i = (8-3)/2 =2,5. La molécule possède un spin total non nul ( présence d'un électron célibataire) : la molécule est paramagnétique. Acidité d’une eau de pluie non
polluée. L’eau de pluie est naturellement acide : en
effet, le dioxyde de carbone présent dans
l’air se dissout dans l’eau et donne lieu
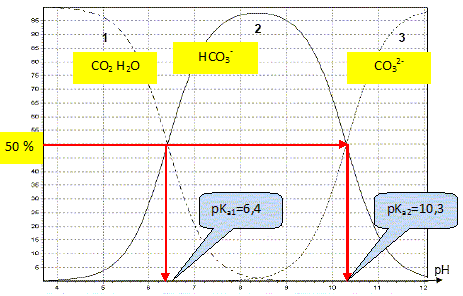
à des équilibres acido-basiques. Étude du diagramme de distribution
associé au dioxyde de carbone en solution
aqueuse. Les proportions des différentes
espèces issues du dioxyde de carbone en
solution, noté (CO2,
H2O), en fonction du pH sont
représentées par les courbes 1, 2 et
3. Donner les formules de
toutes les espèces acido-basiques issues du
dioxyde de carbone en solution ; attribuer les
trois courbes du diagramme aux différentes
espèces carbonées en
solution. Grâce au
diagramme, donner les valeurs des pKa
associés aux couples
concernés. Calculer, en détaillant le raisonnement et en précisant les approximations effectuées, le pH d’une eau de pluie sachant que la concentration de dioxyde de carbone dissous(CO2, H2O) est constante et vaut 7,0 ×10-5 mol.L-1. L'eau est acide : le pH est sans doute voisin de 5 ou 6. En conséquence l'ion CO32- est négligeable devant HCO3- et CO2, H2O. CO2, H2O + H2O = HCO3- + H3O+ (1) Ka1 = [HCO3-][H3O+] / [CO2, H2O] La solution est électriquement neutre : [HCO3- ] =[H3O+], l'ion HO- étant minoritaire à pH<7. Ka1 = [H3O+]2 / [CO2, H2O] ; [H3O+] = [Ka1[CO2, H2O] ]½. pH = 0,5 [ pKa1-log [CO2, H2O] ] = 0,5(6,4-log7,0 10-5)] =5,28 ; pH = 5,3. Acidité d’une eau de pluie polluée. La réaction des oxydes d’azote avec l’ozone contenu dans l’atmosphère provoque la formation d’acide nitrique, acide fort. En supposant que le nuage est « pollué » à une concentration de 6,0×10-5 mol.L-1 en acide nitrique, calculer le pH d’une telle eau polluée. Expliquer alors pourquoi ces pluies sont appelées « pluies acides » L'acide nitrique étant un acide fort, entièrement dissocié en solution, il apporte une quantité d'ion oxonium supplémentaire, égale à 6,0×10-5 mol par litre. Quantité de matière d'ion oxonium dans une eau non polluée : 10-5,28 = 5,2 10-6 mol dans un litre. Quantité de matière totale d'ion oxonium : 6,0×10-5 + 5,2 10-6 =6,5 10-5 mol dans un litre. Nouveau pH : pH = - log (6,5 10-5) = 4,2. Ces pluies sont appellées " pluies acides" car le pH de cette eau de pluie polluée est inférieur d'une unité pH, au pH d'une eau de pluie non polluée.
Objectifs de la chimie verte. Réduction de l’émission de dioxyde de carbone : utilisation de l’éthanol. L’utilisation des carburants à base d’éthanol permet la diminution de l’émission de dioxyde de carbone. On s’intéresse ici à la synthèse de l’éthanol à partir d’éthène et d’eau : C2H4(g) + H2O(g) = C2H6O(g) Étude de l’équilibre. Calculer la valeur de l’enthalpie standard de la réaction à 298 K et commenter le signe de la valeur trouvée. Dr H° (298) = DfH° (C2H6O(g)) -DfH° (H2O(g))-DfH° (C2H4(g)) Dr H° (298) = -234,2 +241,8-52,4 = - 44,8 kJ / mol. L'enthalpie de la réaction étant négative, la réaction est exothermique. Calculer la valeur de l’entropie standard de la réaction à 298 K et commenter le signe de la valeur trouvée. Dr S° (298) = S° (C2H6O(g)) -S° (H2O(g))-S° (C2H4(g)) Dr S° (298) = 282,6 -188,8-219,3 = - 125,5 kJ mol-1 K-1. Initialement il y a deux molécules, C2H4(g) + H2O(g) et à la fin , il n'y en a plus qu'une, C2H6O(g). L'ordre augmente, l'entropie est négative. Rappeler l’énoncé de l’approximation d’Ellingham. Dr H° et Dr S° de la réaction sont indépendants de la température en dehors des changements d'état physique. On suppose que l’approximation d’Ellingham est vérifiée. Calculer la valeur la constante d’équilibre de la réaction à 300 °C. Dr G° = Dr H° - TDr S°. Dr G° = -44,8 103 -(273+300) *(-125,5) = 2,71 104 J /mol. Dr G° = -RT ln K ; ln K = -Dr G° /(RT) = -2,71 104 /(8,31*573) = -5,69 ; K = 2,0 10-6.
Etude du rendement. La transformation est effectuée à 300 °C sous une pression totale égale à P=70 bar à partir à partir d'un mélange d'une mole d'éthèene et de deux moles d'eau. On suppose ici que la constante K de la réaction vaut 3,4 10-3. Vérifier que la valeur de l'avancement à l'équilibre est de 0,13 mol.
Fractionx molaires : éthène : (1-x) / (3-x) ; eau : (2-x) / (3-x) ; éthanol : x/(3-x) Pressions partielles : Péthène =P(1-x) / (3-x) ; Peau = P(2-x) / (3-x) ; Péthanol= Px/(3-x) Constante d'équilibre K = Péthanol / (PéthènePeau ) K = x(3-x) / [P(1-x)(2-x)] soit KP(1-x)(2-x) = x(3-x) 3,4 10-3*70 (2-3x+x2 )= 3x-x2 ; 0,238x2 -0,714 x +0,476 = 3x-x2 ; 1,238x2 -3,714x +0,476 = 0 ; D =3,7142-4*0,476*1,238 =11,4 ; D ½ =3,38 ; x = (3,714-3,38) / (2*1,238) =0,135. L'autre rsolution, supérieure à 1 ne peut pas être retenue. Définir le rendement r de la réaction et le calculer. Quantité de matière d'éthanol à l'équilibre divisée par la quantité de matière initiale du réactif limitant ( éthène) r = 0,13 / 1 = 0,13 ( 13 %). Indiquer l’influence de la pression sur cet équilibre. A température constante, une augmentation de pression déplace l'équilibre vers la droite, sens direct, c'est à dire dans le sens d'une diminution du nombre de molécules. Indiquer l’influence de la température sur cet équilibre. La réaction dans le sens direct étant exothermique, une augmentation de température déplace l'équilibre dans le sens indirect, vers la gauche. Conclure sur les conditions expérimentales utilisées. Une pression élevée déplace l'équilibre dans le sens direct. Une température moyenne augmente la vitesse de la réaction, tout en étant un facteur défavorable du point de vue de déplacement de l'équilibre.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Amélioration des rendements énergétiques : pile à combustible. Une des piles à combustible (dans laquelle il y a un apport continu de réactifs) mise au point récemment est une pile dite à méthanol symbolisée par le schéma suivant : Pt(s) │CH3OH (aq), H+(aq) ││ H+(aq) │O2(g) │ Pt(s) Écrire la demi-équation électronique traduisant l’oxydation du méthanol en dioxyde de carbone. 2 fois { CH3OH + H2O ---> CO2(g) +6H+ +6e- }. Écrire l’équation de la réaction traduisant le fonctionnement de la pile et en donner l’expression de la constante d’équilibre sous la forme d’une puissance de dix. Conclure. 3 fois {O2(g) +4H+ +4e- = 2H2O }. Puis additionner et simplifier : 2CH3OH + 2H2O + 3O2(g) +12H+ +12e- ---> 2CO2(g) +12H+ +12e- +6H2O 2CH3OH + 3O2(g) ---> 2CO2(g) +4H2O. Réaliser un schéma de la pile en fonctionnement en précisant le sens de circulation des électrons, les pôles, les positions de la cathode et de l’anode ainsi que la nature des transformations (oxydation, réduction) aux électrodes. 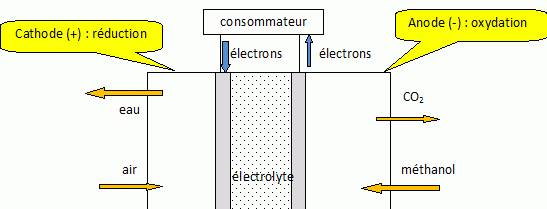 Indiquer une critique possible sur le fonctionnement de la pile étant donné les objectifs écologiques. Cette pile rejette du dioxyde de carbone, gaz à effet de serre. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|