|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||
| .
. |
||||||||
|
||||||||
|
L’analyse par activation neutronique est une technique qui consiste à soumettre l’échantillon à analyser à un flux de neutrons, ce qui conduit à activer un certain nombre d’éléments. Après l’irradiation, les radio-isotopes ainsi créés peuvent être identifiés avec certitude et quantifiés avec précision ; ce qui permet de connaître la nature des éléments initialement présents dans l’échantillon tout en effectuant leur dosage. C’est une méthode d’excellence dans la recherche de traces et d’ultra-traces. Elle s’applique à de très nombreux matériaux (métaux, semi-conducteurs, échantillons archéologiques, biologiques, géologiques…) et également dans l’environnement (dosage des poussières atmosphériques…) et en criminologie (détection de l’arsenic…). C’est une technique analytique souvent non destructive, très sensible (limite de détection inférieure à 10-12 g) et qui permet le dosage simultané multi élémentaire. 1. Source de neutrons. La principale source de neutrons est constituée par des réacteurs nucléaires. Cependant, les sources isotopiques sont un moyen d’irradiation autonome et relativement moins coûteux, qui se prête bien à l’utilisation industrielle pour les dosages rapides et en série de certains éléments. Les neutrons sont alors générés par une source « américium-béryllium ». L’américium 24195Am est un émetteur α. Écrire l’équation de la réaction de désintégration sachant qu’il donne naissance au neptunium Np. 24195Am ---> AZNp + 42He. Conservation de la charge : 95 = Z+2 d'où Z = 93 Conservation du nombre de nucléons : 241 = A +4 d'où A = 237. 24195Am ---> 23793Np + 42He. L’américium est intimement mélangé au béryllium 9. Les particules α émises vont réagir sur le béryllium 9 suivant la réaction : α + 94Be --->AZX + ... n Recopier l’équation de la réaction en la complétant. Identifier l’élément X formé. 42He + 94Be --->AZX + 10n. Conservation de la charge : 2+4 = Z d'où Z = 6 ( élément carbone) Conservation du nombre de nucléons : 4+9 = A +1 d'où A = 12. 42He + 94Be --->126C + 10n.
-------------------O longue chaine carbonée lipophile ; tète hydrophile
L’isotope instable du chlore formé dans la réaction
précédente est radioactif ß-, de temps de demi-vie (ou période radioactive) T½ = 37 min. e rend très dangereux pour les yeux Analyse qualitative et quantitative. L’énergie totale libérée lors de cette réaction de désintégration ß- vaut E = 4,91 MeV. A l’aide d’un détecteur semi-conducteur au germanium associé à un amplificateur et un analyseur multicanaux, on obtient le spectre de rayons γ accompagnant cette désintégration. On observe l’émission de photons γ d’énergie E1 = 1,64 MeV et E2 = 2,17 MeV. Le bruit de fond étant très bas, on atteint une excellente limite de détection. On fournit le schéma de désintégration ß- de l’isotope du chlore 37. 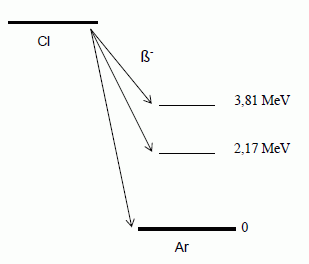
Expliquer quelle est l’origine du rayonnement γ. Le noyau fils d'argon se trouve dans un état excité ; il libère son surplus d'énergie sous forme de photon gamma, afin de revenir à un état de moindre énergie.. Les deux énergies des photons γ sont-elles compatibles avec le schéma de désintégration ? Justifier. On observe l’émission de photons γ d’énergie E1 = 1,64 MeV et E2 = 2,17 MeV. L'énergie du noyau est quantifiée : l'énergie des photons gamma doit correspondre à la différence d'énergie entre deux niveaux d'énergie du noyau. 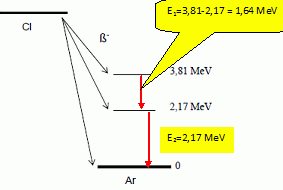 Quand le noyau d’argon est produit dans l’état excité d’énergie E3 = 3,81 MeV, quelle est l’énergie maximale Emax des rayons ß- ? L’énergie totale libérée lors de cette réaction de désintégration ß- vaut E = 4,91 MeV. L'énergie libérée est la somme des énergies du rayon ß- et du rayon gamma : E = E3 +Emax ; Emax = E - E3 =4,91 -3,81 = 1,10 MeV. L’activité de l’échantillon, contenant l’isotope Cl instable, au moment du comptage est A = 2,5 x 104 Bq. Sachant que cette activité a été mesurée 37 min après la fin de l’irradiation, quel était l’ordre de grandeur de l’activité à la fin de l’irradiation (c'est-à-dire juste après avoir obtenu le chlore radioactif) ? L’isotope instable du chlore formé a un de temps de demi-vie (ou période radioactive) T½ = 37 min. Durant une période, l'activité initiale A0 diminue de moitié : A0 = 2 A = 5,0 x 104 Bq. Quel est alors l’ordre de grandeur de la masse de chlore 37 contenu dans l’échantillon ? On donne : la constante d’Avogadro NA = 6 x 1023 mol-1 ; A = λ.N ; ln 2 ≈ 0,7. l T½ = ln2 avec T½ = 37 min = 37*60 =2220 s. l = ln2 / T½ =0,7 / 2220 = 3,12 10-4 s-1. A0 = λ.N0 ; N0 = A0 / λ= 5,0 104 / 3,12 10-4 =1,6 108 noyaux Quantité de matière de chlore 37 : n = N0 / NA =2,7 10-16 mol. Masse molaire du chlore 37 : M = 37 g/mol. masse de chlore 37 dans l'échantillon : m = n M = 2,7 10-16 *37 ~ 10-14 g.
|
||||||||
| |
||||||||
|
|
 Irradiation de l’échantillon
Irradiation de l’échantillon