|
A propos de conservateurs ( bac S Polynésie 2009) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
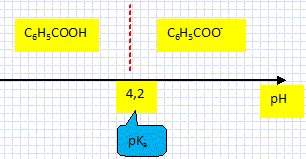
On donne : pKa ( C6H5 COOH aq /C6H5 COO- aq )= 4,2 à 25°C.
Espèce, ion ou molécule susceptible de céder un proton H+. Ecrire l'équation de la réaction entre l'acide benzoïque et l'eau. C6H5 COOH aq + H2O(l) = C6H5 COO- aq + H3O+aq. Déterminer le domaine de prédominance de chaque espèce du couple.
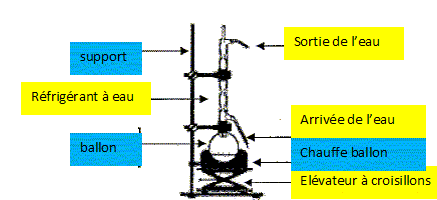
Mettre dans le ballon : 100 mL de solution aqueuse de soude à 0,40 mol/L ; 2,5 mL d'alcool benzylique ; 4,5 g de permanganate de potassium ; quelques grains de pierre ponce. Réaliser un chauffage à reflux et chauffer à ébullition douce pendant 30 min. Il apparaît un précipité marron de dioxyde de manganèse MnO2. L'équation de la réaction notée (1) s'écrit : 3 C6H5CH2OH aq + 4 MnO4- aq = 3 C6H5CO2- aq + 4 MnO2 (s)+ HO- aq + 4 H2O(l). Après refroidissement, filtrer le mélange à l'aide d'un filtre büchner : le filtrat obtenu est incolore. Verser le filtrat dans une ampoule à décanter, y ajouter environ 40 mL de cyclohexane, agiter et dégazer plusieurs fois, laisser reposer : on recueille la phase contenant le benzoate de sodium en solution. Annoter le schéma du montage à reflux.
Quel est l'intérêt d'un chauffage à reflux ? En travaillant à température modérée on accélère la réaction tout en évitant les pertes de matière : les vapeurs se condensent dans le réfrigérant et retombent dans le ballon. Quel composé recueille t-on dans le filtre du büchner ? Justifier. D'après (1) une seule espèce est solide MnO2. De plus l'ion benzoate est très soluble dans l'eau. Sur le filtre on recueille donc le dioxyde de manganèse.
Déterminer la quantité de matière initiale des deux réactifs, l'alcool benzylique et le permanganate de potassium. n(alcool) = masse (g) / masse molaire (g/mol) avec masse(g) = volume (mL) * masse volumique ( g/mL) = 2,5 *1,05 =2,625 g n(alcool) = 2,625 / 108 = 2,43 10-2 ~ 2,4 10-2 mol. n( KMnO4) = m/M = 4,5 / 158 =2,848 10-2 ~ 2,8 10-2 mol. Compléter numériquement le tableau d'avancement et montrer que le réactif en excès est l'alcool.
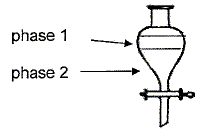
Si l'ion permanganate est en défaut : 2,8 10-2 -4xmax = 0 ; xmax = 2,8 10-2 /4 = 7,1 10-3. On retient la plus petite valeur : 7,1 10-3 ; l'alcool est en excès. Donner le nom des phases 1 et 2 en justifiant et leur composition.
La phase la plus dense ( l'eau d = 1) occupe la partie inférieure ; la phase la moins dense ( le cyclohexane d = 0,78) occupe la partie supérieure. L'alcool benzylique en excès est très soluble dans le cyclohexane. L'ion benzoate, l'ion hydroxyde, l'ion potassium, l'ion sodium sont très solubles dans l'eau.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|