|
Etude d'une solution d'hydroxylammonium ( bac S Polynésie 2009) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
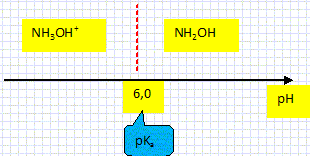
On donne : pKa ( NH3OH+aq / NH2OH aq) = 6,0 à 25°C. Ecrire l'équation de dissolution du chlorure d'hydroxylammonium dans l'eau. NH3OHCl (s) = NH3OH+aq + Cl-aq. Donner la définition d'un acide selon Bronsted. Espèce, ion ou molécule susceptible de céder un proton H+. Ecrire l'équation (1) de la réaction entre l'ion hydroxylammonium et l'eau. NH3OH+aq + H2O(l) = NH2OH aq + H3O+aq. (1) Déterminer le domaine de prédominance de chaque espèce du couple.
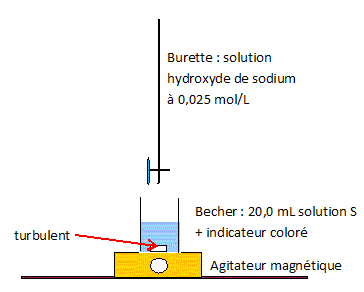
On dose un volume VA = 20,0 mL de la solution S par une solution aqueuse d'hydroxyde de sodium Na+aq + HO-aq de concentration molaire en soluté apporté cB= 2,5 10-2 mol/L. On repère l'équivalence à l'aide d'un indicateur coloré acido-basique. Faire un schéma annoté du montage nécessaire à ce dosage.
Ecrire l'équation (2) de la réaction de dosage entre les ions hydroxylammonium et les ions hydroxyle. NH3OH+aq + HO-aq = NH2OH aq +H2O(l) (2)
Définir l'équivalence. A l'équivalence les quantités de matière de réactifs mis en présence sont en proportions stoechiométriques ; avant l'équivalence l'un des réactif est en excès, après l'équivalence, l'autre réactif est en excès. Le pH du mélange à l'équivalence vaut 9,1. Choisir l'indicateur coloré dans la liste suivante et préciser le changement de couleur à l'équivalence.
Dans le becher, avant l'équivalence, l'acide est en excès ( solution incolore) ; après l'équivalence, la soude est en excès et le pH est supérieur à 9,1, donc teinte rose. Le virage de l'indicateur coloré est obtenu pour un volume versé de la solution aqueuse d'hydroxyde de sodium Véq = 24,0 mL. Calculer CA. Quantité de matière d 'acide : CA VA ; quantité de matière de base : CB Véq ; à l'équivalence CA VA = CB Véq. CA = CB Véq / VA = 0,025 * 24,0 / 20,0 = 0,030 mol/L.
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|