|
Lactose
: concours
kiné 2009. |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
- Acide lactique : formule semi-développée : CH3 -CHOH-COOH ; masse molaire : 90,0 g.mol-1 ; - Le pKa du couple acido-basique de l'acide lactique est égal à 3,8. On notera HA l'acide lactique. L'acide lactique. Donner la formule semi-développée de l'ion lactate, base conjuguée de l'acide lactique. CH3 -CHOH-COO-. Donner l'expression de la constante d'acidité Ka du couple acide lactique / ion lactate. L'ion lactate est noté A-. AH + H2O = A- + H3O+. Ka = [A-][H3O+] / [AH] La mesure au laboratoire du pH d'une solution d'un litre d'acide lactique de concentration c égale à 1,0×10-2 mol.L-1 donne pH = 2,9. Calculer la concentration en ions oxonium dans la solution. [H3O+] = 10-pH = 10-2,9 = 1,26 10-3~ 1,3 10-3 mol/L. En remplissant le tableau d'avancement , calculer la valeur de la constante Ka du couple de l'acide lactique, puis celle de son pKa.
pKa = -log Ka = -log 1,8 10-4 =3,74 ~ 3,7. Quelle peut être la cause du léger écart observé avec la valeur donnée plus haut ? Les valeurs du pH et de la concentration sont données avec seulement deux chiffres significatifs. Une plus grande précision sur celles-ci devrait conduire à pKa = 3,8. Par exemple, un calcul fait à partir de pH = 2,94 conduit à pKa = 3,82.
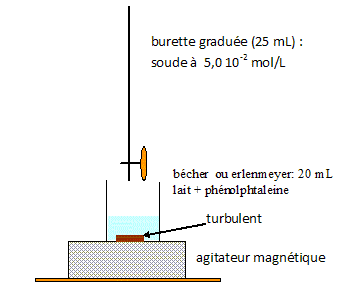
Dosage de l'acide lactique dans un lait. On introduit dans un erlenmeyer 20,0 mL d'un échantillon de lait et quelques gouttes de phénolphtaléine. On ajoute progressivement une solution d'hydroxyde de sodium de concentration 5,0×10-2 mol.L-1. Le changement de couleur du milieu réactionnel est observé pour un volume de solution d'hydroxyde de sodium ajouté égal à 9,2 mL. Faire le schéma annoté du montage expérimental.
|
|||||||||||||||||||||||||||||||
|
c |
|||||||||||||||||||||||||||||||
|
|